在密闭容器中,将0.020 mol·L-1CO和0.020 mol·L-1H2O(g)混合加热到773K时,达到下列平衡CO(g)+H2O(g)  CO2(g)+H2(g),已知该反应的KC=9,求CO的平衡浓度和转化率。
CO2(g)+H2(g),已知该反应的KC=9,求CO的平衡浓度和转化率。
已知实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
(1)标准状况下生成Cl2的体积。
(2)反应生成的MnCl2的质量为。
硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用。在实验室,浓硫酸是常用的干燥剂。
完成下列计算:
(1)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为 。
(2)将1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70 mL。通过计算确定浓硫酸被还原的产物是 。
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2→Fe3O4+6SO2
4FeS2+11 O2→2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量各为多少?
(4)闪锌矿(主要成份为ZnS)是含锌主要矿物之一,高温加热闪锌矿生成ZnO和SO2。ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸。计算回答下列问题(计算保留2位小数)
取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32 g,样品中含硫化锌的质量分数是多少?
生产10吨98%的浓硫酸需要这种矿石多少吨?(反应过程中硫损失2%)
常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的c(H+)。
(3)电解至t3时,消耗水的质量。
某有机物,它的相对分子质量为60。 6.0g该有机物完全燃烧后的产物通过浓硫酸后增重7.2g,通过足量澄清石灰水后有30g白色沉淀生成。求:
(1)该有机物的分子式;
(2)写出能与钠反应的该有机物的所有同分异构体的结构简式。
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.
(1)a点对应的沉淀为______________(填化学式)。
(2)计算原混合液中FeCl3的物质的量浓度为多少?(写出计算过程)
将25.6g铜与足量的浓硫酸共热,完全反应后,试计算:
(1)生成的SO2在标准状况下的体积;
(2)被还原的硫酸的物质的量。
常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算: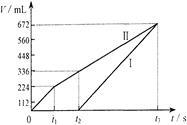
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的c(H+)。
(3)电解至t3时,消耗水的质量。
已知25℃时,Ksp(Mg(OH)2)=1.8×10-11,Ksp(Cu(OH)2)=2.2×10-20。请按要求回答下列问题:
(1)在25℃下,向浓度均为0.1 mol・L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成____________沉淀(填化学式),生成该沉淀的离子方程式为________________。
(2)25℃时,向0.01 mol・L-1的MgCl2溶液中,逐滴加入浓NaOH溶液,当Mg2+完全沉淀时,溶液的pH为_______________(忽略溶液体积变化,已知lg1.8=0.26)。
(3)已知25℃时,Ksp(Fe(OH)3)=2.79×10-39,试求该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K,写出计算推理过程。
Fe3++3H2O的平衡常数K,写出计算推理过程。
氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH 3OH和H 2O在某Cu/Zn﹣Al催化剂存在下生产H 2,H 2与Mg在一定条件下制得储氢物质X。
回答问题:
(1)Al在周期表中的位置 。基态Zn的价层电子排布式 。
(2)水分子中氧原子的杂化轨道类型 。
(3)键能是衡量共价键稳定性的参数之一。 CH 3OH键参数中有 种键能数据。CH 3OH可以与水以任意比例互溶的原因是 。
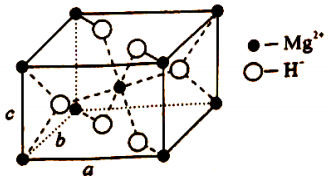
(4)X的晶胞结构如图所示(晶胞参数:α=β=γ=90°,a=b=450.25pm),密度为1.4g•cm ﹣ 3,H ﹣的配位数为 ,X的储氢质量分数是 ,c= pm (列出计算式即可)。
将6g的铁粉加入200mL Fe2(SO4)3和CuSO4的混合溶液,充分反应得到200mL 0.5mol/LFeSO4溶液和5.2g固体沉淀物。试计算
(1)反应后生成铜的质量;
(2)原Fe2(SO4)3溶液的物质的量浓度。
某厂每天产生800m3含氮的废水(NH3的含量为168mg∙L-1)。该厂处理废水的方法是:将废水加热得到NH3,使废水中NH3的含量降为15mg∙L-1(假设废水处理前后体积不变)。再对加热蒸发得到的NH3进一步处理制取硝酸。
(1)制取硝酸过程中主要发生反应如下:①_________________,②4NO+3O2+2H2O=4HNO3。反应①是氨气在一定条件下被氧气氧化,请在横线上写出该反应的化学方程式。
(2)该厂每天通过加热蒸发可得到NH3的物质的量是__________________。
(3)若在反应①中N元素损失10%,则该厂每天可生产硝酸多少吨?(写出计算过程,结果保留2位小数)
氢气是化工行业重要原料之一。
(1)电解饱和食盐水是生产H2的方法之一。常温下,电解250 mL饱和食盐水一段时间后,溶液质量减轻0.365 g(假设气体全部逸出)。生成的氢气在标准状况下的体积为 mL。
(2)在电弧炉中,甲烷裂解产生乙炔和氢气,若1 m3 甲烷经此过程生成0.27 m3氢气,则甲烷的裂解率为 %(体积均在相同条件下测定)。
(3)已知:CxHy + H2O → CO + CO2 + H2(未配平)。工业上用甲烷、乙烷的混合气体利用上述反应生产氢气,反应后气体经干燥组成如下表所示:
| 组分 |
CO |
CO2 |
H2 |
| 体积分数 |
20% |
5% |
75% |
计算原混合气体中甲烷与乙烷的物质的量之比。
(4)合成氨生产过程中,消耗氮氢混合气2000 m3(其中CH4的体积分数为0.112%,下同),分离液氨后的氮氢混合气中含CH4 2.8%。计算分离出液氨为多少吨(保留2位小数,所有体积均已折算至标准状况)。
碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·x H2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和 。
(2)MgaAlb(OH)c(CO3)d·x H2O中a、b、c、d的代数关系式为 。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390g样品与足量稀盐酸充分反应,生成CO20.560L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如右图所示(样品在2700C时已完全失去结晶水,6000C以上残留固体为金属氧化物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-): n(CO32-)(写出计算过程)。
