“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中,“纳米材料”是指直径以几纳米到几十纳米的材料,如将“纳米材料”分散到液体分散剂中,所得混合物可能具有的性质( )
| A.分散质粒子不能透过滤纸 | B.具有丁达尔效应 |
| C.分散质很快就沉降下来 | D.所得分散系是溶液 |
下列有关溶液性质的叙述,正确的是( )
| A.室温时饱和的二氧化碳水溶液,冷却到0 ℃时会放出一些二氧化碳气体 |
| B.20 ℃,100 g水中可溶解34.2 g KCl,此时KCl饱和溶液的质量分数为34.2% |
| C.强电解质在水中溶解度不一定大于弱电解质 |
| D.相同温度下,把水面上的空气换成相同压力的纯氧,100 g水中溶入氧气的质量增加 |
下列溶液中微粒浓度关系一定正确的是
A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH ) ) |
| B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
C.0.1 mol·L 的硫酸铵溶液中:c(NH 的硫酸铵溶液中:c(NH )>c(SO )>c(SO )>c(H+) )>c(H+) |
D.0.1 mol·L 的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+2C(H2S) 的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+2C(H2S) |
右图为元素周期表短周期的一部分。
关于A~G七种元素的叙述正确的是( )
A.E、F、G形成的单质中都含有共价键
B.形成的简单阴离子半径:E>F>C>D
C.B、C、D三种元素的氢化物的稳定性依次减弱
D.A、B、E的氢化物都能跟HNO3发生化合反应
下列叙述不正确的是( )
| A.活泼金属与活泼非金属化合时,能形成离子键 |
| B.阴、阳离子通过静电引力所形成的化学键叫做离子键 |
| C.离子所带电荷的符号和数目与原子成键时得失电子数有关 |
| D.阳离子半径比相应的原子半径小,而阴离子半径比相应的原子半径大 |
最新研究表明生命起源于火山爆发,因为火山爆发产生的气体中含有1%的羰基硫(化学式为COS,CO就是羰基),已知羰基硫分子中所有原子最外层均满足8电子稳定结构,结合元素周期表知识,下列有关说法正确的是( )
A.羰基硫中O为-2价,C、S都是+1价
B.羰基硫分子中共含有3个原子核、16个电子
C.羰基硫的电子式为:········C········
D.羰基硫分子结构中只含有极性共价键
下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中不能表示等质量的氢气与氦气的是( )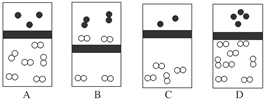
下图是同学们经常使用的某品牌修正液包装标签。小明仔细阅读后,结合自己的生活经验和所学知识得出了该修正液的某些性质,小明的推测中不合理的是( )
| A.修正液是一种胶体,均一、透明 |
| B.修正液中含有的化学物质有毒 |
| C.修正液的成分对纸张不具有腐蚀性 |
| D.修正液的溶剂易挥发、易燃 |
X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,下列的说法正确的是
| A.X可能是第二周期非金属元素 | B.X可能是第三周期金属元素 |
| C.Y可能与X同主族 | D.Y一定是金属元素 |
A、B为同主族的两元素,A在B的上一周期,若A的原子序数为n,则B的原子序数不可能为
A.n+8 B.n+18 C.n+20 D.n+32
下列说法正确的是
| A.形成离子键的阴阳离子间只存在静电吸引力 |
| B.HF、HCL、HBr、HI的热稳定性和还原性从左到右依次减弱 |
| C.第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| D.元素周期律是元素原子核外电子排布周期性变化的结果 |
下列关于元素周期律的叙述正确的是
| A.随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 |
| B.随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 |
| C.随着元素原子序数的递增,原子半径从小到大(稀有气体除外)发生周期性变化 |
| D.元素性质的周期性变化是指原子核外电子排布、原子半径及元素主要化合价的周期性变化 |
锗(Ge)是第四周期第ⅣA 元素,处于周期表中金属区与非金属区的交界线上,下列叙述正确的是
| A.锗是一种金属性很强的元素 | B.锗的单质具有半导体的性能 |
| C.锗化氢(GeH4)稳定性比CH4强 | D.锗酸(H4GeO4)是难溶于水的强酸 |
海洋中有丰富的食品、矿产,能源、药 物和水产资源等(如下图所示),
物和水产资源等(如下图所示),
下列有关说法不正确的是 ( )
| A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能量的过程 |
| B.过程②中结晶出的MgCl2·6H20要在HCl氛围中加热脱水制得无水MgCl2 |
| C.在过程③⑤中溴元素均被氧化 |
D.过程①中除去粗盐中的S042-、Ca2+、Mg2+ 、Fe3+等杂质,加入的药品顺序为:Na2C03溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 、Fe3+等杂质,加入的药品顺序为:Na2C03溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C2AlN+3CO下列叙述正确的是( )
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2 mol AlN,N2得到3 mol电子 |
| C.氮化铝中氮元素的化合价为-3 |
| D.氮化铝晶体属于分子晶体 |