对实验Ⅰ~Ⅳ的实验现象预测正确的是( )
(提示:Ca(OH)2+2NH4Cl=2NH3↑+CaCl2+2H2O)
| A.实验Ⅰ:液体分层,下层呈无色 |
| B.实验Ⅱ:烧杯中先出现白色沉淀后溶解 |
| C.实验Ⅲ:试管中溶液出现红色沉淀物 |
| D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
以下物质间的每步转化通过一步反应能实现的是( )
| A.Al-Al2O3-Al(OH)3-NaAlO2 |
| B.Fe-FeO-Fe(OH)2-Fe(OH)3 |
| C.Si-SiO2-H2SiO3-Na2SiO3 |
| D.Na-Na2O2-Na2CO3-NaOH |
设NA为阿伏加德罗常数,下面叙述正确的是 ( )
| A.标准状况下,11.2L SO3所含分子数为0.5 NA |
| B.1L 1mol/L的氯化钠溶液中,所含离子数为NA |
| C.常温下,4.4g CO2和N2O(不反应)混合物中所含有的原子数为0.3 NA |
| D.一定量的铜与足量的浓硫酸反应,放出2.24L气体时,转移电子数为0.2 NA |
下列离子方程式正确的是( )
| A.澄清石灰水中滴加稀硫酸:Ca(OH)2+2H+====Ca2++2H2O |
| B.实验室用氨水制备少量Al(OH)3:Al3++ 3OH-====Al(OH)3↓ |
| C.向FeBr2溶液中通入过量氯气:2Fe2++Cl2====2Fe3++2Cl- |
| D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液: |
Ca2++ +2OH-====CaCO3↓+
+2OH-====CaCO3↓+ +2H2O
+2H2O
在溶液中加入过量Na2O2后仍能大量共存的离子组是( )
| A.NH4+、Ba2+、Cl-、NO3- | B.K+、AlO2-、Cl-、SO42- |
| C.Ca2+、Mg2+、NO3-、HCO3- | D.Na+、Cl-、CO32-、SO32- |
将SO2气体通入BaCl2溶液至饱和,未见有沉淀生成,继续通入另一种气体仍无沉淀
产生,则通入的气体可能是( )
| A.O2 | B.CO2 | C.Cl2 | D.SO3 |
最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
A.分子中三个碳原子可能处于同一直线上
B.全氟丙烷的电子式为:
C.相同压强下,沸点:C3F8<C3H8
D.全氟丙烷分子中既有极性键又有非极性键
设NA代表阿伏加德罗常数,下列说法正确的是( )
| A.23g金属钠变为钠离子时失去的电子数为NA |
| B.标准状况下,18g水所含的电子数目为9NA |
| C.标准状况下,11.2L氦气所含的原子数目为NA |
| D.标准状况下,2.24 LN2和O2的混合气体所含原子数为0.1NA |
能证明反应:H2(g)+ I2(g)  2HI(g)已经达到平衡状态的是
2HI(g)已经达到平衡状态的是
①c(H2):c(I2):c(HI)=1:1:2
②单位时间内生成nmolH2的同时消耗nmolI2
③反应速率2v(H2)=2v(I2)= v(HI)
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
⑥温度和体积一定时,混合气体的颜色不再变化
| A.①③ | B.②⑥ | C.③⑥ | D.④⑤ |
如下图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O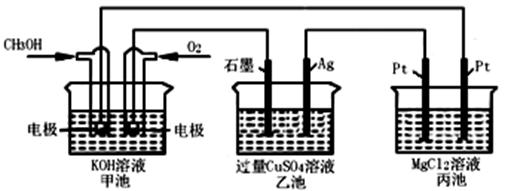
下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体 |
中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
| A.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C.根据F、Cl、Br、I非金属性依次减弱,推出HF、HCl、HBr、HI的酸性依次减弱 |
| D.若M+和R2-的核外电子层结构相同,则可推出原子序数:R>M |
下列各组离子在指定溶液中能大量共存的是
①常温下,c(H+)/c(OH—)=1×10-12的溶液:K+、AlO2-、CO32-、Na+
②加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-
③使酚酞变红的溶液:Fe3+、Al3+、NO3-、SO42-
④使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl-
⑤无色溶液中:K+、Al3+、NO3-、HCO3-
| A.②③ | B.①③ | C.① | D.①④⑤ |
下列离子方程式不正确的是
| A.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O |
| B.为缓解胃酸过多,服含NaHCO3的抗酸药:HCO3—+H+=H2O+CO2↑ |
| C.过量Na投入AlCl3溶液:Al3+ + 4Na + 2H2O = AlO2- + 4Na+ + 2H2↑ |
| D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀: |
2Ba2++Al3++2SO42-+4OH-===AlO2-+2BaSO4↓+ 2H2O
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,22.4L己烷中共价键数目为19NA |
| B.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
| C.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA |
| D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32- |
光气(COCl2)的分解反应为:COCl2(g) Cl2(g)+CO(g);△H=+108kJ·mol-1。反应体系中各物质的浓度在不同条件下的变化如图8所示(10~14 min的COCl2浓度变化未标出):
Cl2(g)+CO(g);△H=+108kJ·mol-1。反应体系中各物质的浓度在不同条件下的变化如图8所示(10~14 min的COCl2浓度变化未标出):
下列说法正确的是
| A.COCl2在5~6 min和15~16 min时平均反应速率:v(5~6)< v(15~16) |
| B.第10 min时,改变反应条件,反应重新达到平衡前:v(正)>v(逆) |
| C.第12 min时,反应重新达到平衡,c(COCl2)≈ 0.03 mol·L-1 |
| D.第14 min时,改变的条件是减小压强,随着平衡的移动,COCl2的转化率减小 |