有一混合溶液,其中只含 有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数
有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数
比为2∶ 3∶4,向该溶液中通入氯气,使溶液中Cl- 和Br-的个数比为3∶1,则通入氯气的物质的量与溶液
3∶4,向该溶液中通入氯气,使溶液中Cl- 和Br-的个数比为3∶1,则通入氯气的物质的量与溶液 中剩余的Fe2+的物质的量之比为
中剩余的Fe2+的物质的量之比为
| A.7∶1 | B.7∶3 | C.7∶2 | D.7∶4 |
将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合溶液中并加热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如图所示。
则原溶液中Al3+、Mg2+、NH4+的物质的量分别为 ( )
| A.2 mol、3 mol、8 mol | B.3 mol、2 mol、8 mol |
| C.2 mol、3 mol、4 mol | D.3 mol、2 mol、4 mol |
核磁共振造影增强剂用于疾病诊断,还可作为药物载体用于疾病的治疗。为磁性纳米晶体材料在生物医学领域的应用提供了更广泛的前景。制备纳米四氧化三铁过程如下:
下列有关叙述不合理的是:( )
| A.纳米四氧化三铁具有磁性作为药物载体用于疾病的治疗 |
| B.反应③的化学方程式是:6FeOOH+CO=2Fe3O4+3H2O+CO2 |
| C.纳米四氧化三铁分散在适当溶剂中,它与溶液分散质直径相当 |
| D.在反应②环丙胺的作用可能是促进氯化铁水解 |
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
| A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl- |
| B.x=0.6a,2Br-+ Cl2=Br2+2Cl- |
| C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- |
| D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- |
一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
| A.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大 |
B.保持温度和活塞位置不变,在甲中 再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 |
| C.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
D.保持温度不变,移动活塞 P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
向含有1 mol HNO3和1mol H2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是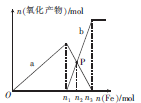
| A.a表示Fe3+的关系曲线 |
| B.n1=0.75 |
| C.P点时,n(Fe2+)="0.5625" mol |
| D.向P点溶液中加入铜粉,最多可溶解14.4 g |
下图①表示向含MgCl2、AlCl3、NH4Cl三种物质的混合溶液中逐滴加入NaOH溶液时,沉淀的物质的量与NaOH溶液的体积关系;图②表示某反应过程中的能量关系。下列各表述与示意图不一致的是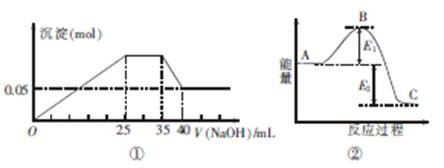
| A.图①中三种离子的物质的量之比n(Mg2+):n(Al3+):n(NH+4)=1:1:2 |
| B.图①中使用的NaOH的浓度为2 mol·L-1 |
| C.图②中若使用催化剂,B点会降低 |
| D.图②中若由物质C反应生成物质A,则反应的活化能为E1+E2 |
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2。下列说法中不正确的是
| A.该电池的负极反应为2SOCl2 + 4e— = S +SO2+4Cl— |
| B.该电池的负极反应为4Li = 4Li+ + 4e— |
| C.反应SOCl2 + H2O = SO2↑ + 2HCl↑为非氧化还原反应 |
| D.组装该电池必须在无水的条件下进行 |
在pH为4-5的环境中,Cu2+和Fe2+不水解,而Fe3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右。在慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去所得CuCl2溶液中的杂质离子,下列方法中可行的是
| A.加入HNO3将Fe2+氧化成Fe3+,再加水稀释至pH4-5 |
| B.向溶液中通入Cl2,再加入CuO粉末调节至pH4-5 |
| C.向溶液中通入Cl2,在通入NH3调节至pH4-5 |
| D.向溶液中通入H2O2, 再加入CuO粉末调节至pH4-5 |
一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下:
2AtI+2Zn===ZnI2+ZnAt2 AtI+2NH3(l)===NH4I+NH2At。
则下列叙述正确的是
| A.ZnI2既是氧化产物,又是还原产物 |
B.ZnAt2既是氧化产物, 又是还原产物 又是还原产物 |
| C.AtI与液氨反应,AtI既是氧化剂,又是还原剂 |
| D.AtI与液氨反应,是自身氧化还原反应 |
用CH4催化还原NOx可以消除氮氧化合物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
下列说法中错误的是( )
| A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l);△H>-574kJ/mol |
| B.等物质的量的CH4在反应①、②中转移电子数相同 |
| C.若用标准状况下4.48L CH4把NO2还原为N2(生成的水为气态),放出热量173.4kJ |
| D.若用标准状况下4.48L CH4把NO2还原为N2,整个过程中转移的电子总数为1.6mol |
将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+3Y(g)  2Z(g) ΔH<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g) ΔH<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
| |
改变条件 |
新平衡与原平衡比较 |
| A |
升高温度 |
X的转化率变小 |
| B |
增大压强 |
X的浓度变小 |
| C |
充入一定量Y |
Y的转化率增大 |
| D |
使用适当催化剂 |
X的体积分数变小 |
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g) + 3B(g)  2C(g) ΔH="-192" kJ·mol-1。向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。
2C(g) ΔH="-192" kJ·mol-1。向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。
下列说法正确的是
| A.若平衡时A气体在两容器中的体积分数相等,则x一定等于y |
| B.若x:y=1:2,则平衡时,M中的转化率:A>B |
| C.若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% |
| D.若x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,再通入0.36 mol A时, |
v(正)<v(逆)
下列有关溶液中粒子浓度的关系式中,正确的是( )
A.pH相同的①CH3COONa、②NaHCO3、③C6H5ONa三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中: c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.右图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.右图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)