一定条件下存在反应:(
)+
2
(
)

2(
)+
2(
),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1
和1
2
,在Ⅱ中充入1
2和1
2,在Ⅲ中充入2
和2
2
,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
| A. | 容器Ⅰ、Ⅱ中正反应速率相同 |
| B. | 容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C. |
容器Ⅰ中
|
| D. |
容器Ⅰ中
|
下图表示取1 mol乙烯雌酚进行的四个实验,下列对实验数据的预测与实际情况吻合的是( )
| A.①中生成7 mol H2O | B.②中生成2 mol CO2 |
| C.③中最多消耗3 mo1 Br2 | D.④中最多消耗7 mol H2 |
在恒温恒容的密闭容器中,发生反应3A(g)+B(g) xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法正确的是
A、若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B、若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C、若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D、若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)="=12" n(B)时,可断定x=4
某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA- H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液:
① 0.01mol・L1的H2A溶液
② 0.01mol・L1的NaHA溶液
③ 0.02mol・L1的HCl溶液与0.04mol・L1的NaHA溶液等体积混合
④ 0.02mol・L1的NaOH溶液与0.02mol・L1的NaHA溶液等体积混合
下列关于上述四种溶液的说法正确的是( )
A.溶液②中存在水解平衡:HA―+H2O  H2A+OH―
H2A+OH―
B.溶液③中有:c(HA-)+2c(A2-)=c(Na+)
C.溶液④中有:c(OH-)=c(H+)+c(HA-)
D.四种溶液中c (HA-)浓度大小:③>①>②>④
常温下,0.1 mol/L氨水溶液中 =1×10-8,下列叙述错误的是
=1×10-8,下列叙述错误的是
| A.该溶液中氢离子的浓度:c(H+ ) = 1×10-9 mol/L |
| B.0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中: c(NH4+ ) + c(H+ ) = c(Cl- ) + c(OH-) |
| C.0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中: c(NH4+ ) + c(NH3) + c(NH3·H2O) = 2c(SO42-) |
| D.浓度均为0.1 mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则 |
c(NH4+ )> c(NH3·H2O) > c(Cl-) > c(OH-) > c(H+ )
下列说法正确的是:
A.在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g) H2O(l) 的ΔH =" 40.69" kJ·mol-1 H2O(l) 的ΔH =" 40.69" kJ·mol-1 |
| B.已知MgCO3的Ksp =" 6.82" × 10-6,则所有含有固体MgCO3的溶液中,都有 c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-) =" 6.82" × 10-6 |
C.已知: 则可以计算出反应 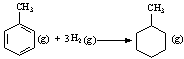 的ΔH为-384 kJ·mol-1 的ΔH为-384 kJ·mol-1 |
| D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小 |
下列说法正确的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。 若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
常温下,下列溶液中的微粒浓度关系正确的是
| A.新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH‑) |
| B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-) > c(H2CO3) |
| C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-) = c(NH4+) > c(OH‑) = c(H+) |
| D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合: |
2c(H+) – 2c(OH-) = c(CH3COO-) – c(CH3COOH)
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.某溶液中由水电离出的c(OH-) = 1×10-amol·L-1,若a>7时,则该溶液的pH一定为14-a
B.等体积、等物质的量浓度的Na2SO3溶液与NaHSO3溶液混合:
c(Na+) = c(SO32-) + c(HSO3-) + c(H2SO3)
C.将0.2mol·L-1的某一元酸HA溶液和0.1mol·L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:2c(OH-)+c(A-)=2c(H+)+c(HA)
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(Na+)>2c(R2-)+c(HR-)
工业上常用还原沉淀法处理含铬废水(Cr2O72—和CrO42—),其流程为:
已知:
(1)步骤①中存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH 一(aq)
Cr3+(aq)+3OH 一(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在.下列有关说法中,正确的是
| A.步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42—离子浓度增大 |
| B.步骤①中当溶液呈现深黄色,且2v(CrO42 一)=v(Cr2O72—)时,说明反应 2CrO42—(黄色)+2H+  Cr2O72—(橙色)+H2O 达到平衡状态 Cr2O72—(橙色)+H2O 达到平衡状态 |
| C.步骤②中,若要还原1 mol Cr2O72一离子,需要6 mol(NH4)2Fe(SO4)2·6H2O。 |
| D.步骤③中,当将溶液的pH 调节至4 时,可认为废水中的铬元素已基本除尽 |
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25 ℃时:
①HF(aq)+OH-(aq)===F-(aq)+H2O(l)  H=-67.7 kJ·mol-1
H=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)===H2O(l)  H=-57.3 kJ·mol-1
H=-57.3 kJ·mol-1
在20 mL 0.1 mol·L-1氢氟酸中加入V mL 0.1 mol·L-1 NaOH溶液,下列有关说法正确的是( )
A.氢氟酸的电离方程式及热效应可表示为:HF(aq) F-(aq)+H+(aq) F-(aq)+H+(aq)  H=+10.4 kJ·mol-1 H=+10.4 kJ·mol-1 |
| B.当V=20时,溶液中:c(OH-)=c(HF)+c(H+) |
| C.当V=20时,溶液中:c(F-)<c(Na+)=0.1 mol·L-1 |
| D.当V>0时,溶液中一定存在:c(Na+)>c(F-)>c(OH-)>c(H+) |
常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如下图。下列说法正确的是( )。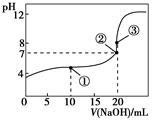
| A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
| B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) |
| C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
在容积固定不变的密闭容器中,可逆反应:A2(g)+B2(g) nC(g)符合下列图1所示关系。由此推断,对图Ⅱ的说法不正确的是( )
nC(g)符合下列图1所示关系。由此推断,对图Ⅱ的说法不正确的是( )
| A.Y轴表示A2的转化率 | B.Y轴表示C的浓度 |
| C.Y轴表示混合气体的密度 | D.Y轴表示混合气体的平均摩尔质量 |
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是

| A.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO |
| B.b点对应的溶液中大量存在:NH、Ba2+、OH-、I- |
| C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、HCO |
| D.d点对应的溶液中大量存在:Na+、K+、SO、Cl— |
下列有关溶液中微粒浓度关系的叙述正确的是
| A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4) > c[(NH4)2SO4]> c(NH4Cl) |
| B.已知HF的酸性比CH3COOH强,pH相等的NaF与CH3COOK溶液中,[c(Na+)-c(F-)]< [c(K+)-c(CH3COO-)] |
| C.等物质的量浓度Na2CO3溶液和NaHCO3溶液等体积混合,所得溶液中:c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c(H2CO3) |
| D.溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(C1O-)=c(HCO3-)+c(H2CO3)+c(CO32-) |