常温下,下列各组离子在指定溶液中一定能大量共存的是()
| A.c(OH-)/c(H+)=1010的溶液:K+、Fe3+、Cl-、NO3- |
| B.能生成Al(OH)3的溶液中:Na+、K+、ClO-、SO32- |
| C.能使酚酞变红的溶液:Na+、Ba2+、NO3-、I- |
| D.澄清透明的无色溶液:NH4+、K+、MnO4-、SO42- |
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH= 2Fe(OH)3 + 2KI; 3I2 + 6KOH=" 5KI" + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:
4NaClO  3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是:()
| A.氧化性(酸性溶液):FeCl3 > Co(OH)3> I2 |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO4 > NaClO |
| D.酸性(水溶液):HSCN > H2CO3 > HCN |
有机物A 是农药生产中的一种中间体,结构简式如下图所示。下列叙述中正确的是
| A.1mol A最多能与4mol H2发生加成反应 |
| B.有机物A可以在一定条件下与HBr发生反应 |
| C.有机物A与浓硫酸混合加热,可以发生消去反应 |
| D.1mol A与足量的NaOH溶液反应,最多可以消耗2mol NaOH |
下表是元素周期表的一部分,有关说法正确的是
| 族 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 2 |
c |
d |
|||||
| 3 |
a |
b |
e |
f |
A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,c元素单质的化学性质最活泼
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强
下列各组离子,在指定环境中一定能大量共存的是
| A.pH=7的溶液中:Al3+、K+、SO42-、HCO3- |
| B.FeCl2溶液中:SO42-、H+、MnO4-、Na+ |
| C.能使pH试纸变深红色的溶液中:S2-、SO32-、S2O32-、SO42- |
| D.滴加甲基橙试剂显红色的溶液中:Na+、NH4+、Cl-、NO3- |
下列离子方程式中错误的是
| A.稀氨水吸收足量SO2:NH3·H2O + SO2= NH4++ HSO3- |
| B.向Ca(ClO)2溶液中通入过量二氧化碳:ClO-+ H2O + CO2=" HClO" + HCO3- |
| C.稀硝酸中加入铁粉:2Fe + 6H+= 2Fe3++ 3H2↑ |
| D.过氧化钠与冷水反应:2Na2O2+ 2H2O = 4Na++ 4OH-+ O2↑ |
用NA代表阿佛加德罗常数,下列说法正确的是
| A.360g C60晶体中的分子数为NA |
| B.标况下,11.2L SO3所含的分子数目为0.5NA |
| C.0.1mol/L稀硫酸中含SO42-离子个数为0.1NA |
| D.0.1mol CH5+所含的电子数目为NA |
下列叙述正确的是
| A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 |
| B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)后者大 |
| D.0.1 mol·L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的容器中,发生反应:2SO2+O2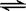 2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
| A.2 mol SO2+ 1 mol O2 | B.1mol SO2+ 1 mol O2 |
| C.2 mol SO2+ 1 mol O2+ 2 mol SO3 | D.1 mol SO2+ 1 mol SO3 |
无色的混合气体甲中可能含NO、CO2、NO2、NH3、N2中的几种。将100 mL气体甲经过下图实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( )
| A.NH3、NO2、N2 | B.NH3、NO、CO2 |
| C.NH3、NO2、CO2 | D.NO、CO2、N2 |
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二。
下列分析不正确的是:()
A.0~4分钟时,A的速率为0.01mol/(L•min) B.由T1向T2变化时,V正> V逆
C.该反应的平衡常数表达式K= D.此反应的正反应为吸热反应.
D.此反应的正反应为吸热反应.
下列离子方程式书写正确的是( )
| A.铝片放入NaOH溶液中:2Al+2OH-===2AlO2-+H2↑ |
| B.碳酸钙溶于醋酸中:CaCO3+2H+===Ca2++CO2↑+H2O |
| C.氯气通入NaOH稀溶液中:Cl2+2OH-===Cl-+ClO-+H2O |
| D.Ba(OH)2溶液与过量NaHSO4溶液混合:H++SO42-+Ba2++OH-===BaSO4↓+H2O |
某实验小组对一含有Al3+的未知溶液进行了如下分析:(1)滴入少量氢氧化钠,无明显变化;(2)继续滴加NaOH溶液,有白色沉淀;(3)滴入过量的氢氧化钠,白色沉淀明显减少。实验小组经定量分析,得出如图所示沉淀与滴入氢氧化钠体积的关系。下列说法错误的是( )
| A.该未知溶液中至少含有3种阳离子 |
| B.滴加的NaOH溶液的物质的量浓度为5 mol·L-1 |
| C.若另一种离子为二价阳离子,则a=10 |
| D.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g |
某无色溶液中可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤 |
操作 |
现象 |
| (1) |
用pH试纸检验 |
溶液pH大于7 |
| (2) |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
| (3) |
向(2)所得的水溶液中加入 Ba(NO3)2和稀HNO3 |
有白色沉淀产生 |
| (4) |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是
A.肯定含有的离子是①④⑤B.肯定没有的离子是②⑤
C.不能确定的离子是①D.不能确定的离子是③⑤