下列各组离子,一定能在指定环境中大量共存的是
| A.在含有大量I-离子的溶液中:Cl¯、Fe3+、Al3+、Cu2+ |
| B.滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3-能够大量共存 |
| C.在由水电离出的c(H+)=10-12 mol·L-1的溶液中:Na+、Ba2+、Cl¯、Br¯ |
| D.在加入Al能放出大量H2的溶液中:NH4+、SO42¯、C1¯、HCO3¯ |
下列离子方程式中,正确的是
| A.氯化铁溶液中加入铜粉:Fe3++Cu ="=" Fe2++Cu2+ |
| B.将含等物质的量的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-="=" BaCO3↓+H2O |
| C.少量SO2通入次氯酸钙溶液中:Ca2++2ClO- +SO2+H2O ="=" CaSO3↓+2HClO |
| D.少量AlCl3溶液滴入过量氨水中:Al3++4NH3•H2O="=" AlO2- +4NH4+ +2 H2O |
下列化学用语表达正确的是
| A.苏打溶液与稀盐酸反应的离子反应方程式:HCO3-+H+=== CO2↑+H2O |
| B.氨气溶于水显碱性的原因:NH3+ H2O === NH3·H2O ===NH4++ OH- |
C.饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体的离子方程式:Fe3++3H2O Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |
| D.CO2通入到纯碱饱和溶液中反应的化学方程式: Na2CO3+CO2+H2O === 2NaHCO3↓ |
下列各组稀溶液:①氨水和硝酸银②NaAlO2和盐酸③硫酸氢钠和氢氧化钡④硝酸和碳酸钠。只用试管、滴管及闻气味就能鉴别的是
| A.③④ | B.①②④ | C.①②③④ | D.②④ |
某无色溶液中只可能含有①Na+ 、②Ba2 +、③Cl-、④Br-、⑤SO32-、⑥SO42-离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤 |
操作 |
现象 |
| (1) |
用pH试纸检验 |
溶液的pH大于7 |
| (2) |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙红色 |
| (3) |
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
| (4) |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是
A.肯定含有的离子是①④⑤B.肯定没有的离子是②⑤
C.可能含有的离子是①⑥ D.不能确定的离子是④③⑥
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
| A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| B.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
| C.标准状况下,11.2 LNH3中含有的电子数为5NA |
| D.常温常压下,22.4L氯气与足量铁粉充分反应,转移的电子数为2NA |
下列各组离子在指定条件下,—定能大量共存的是
| A.能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO32-、NO3- |
| B.c(H+)=10—1mol/L的透明溶液中:Cu2+、Al3+、SO42-、NO3- |
| C.能使氢氧化铝迅速溶解的溶液:Na+、Fe2+、NO3-、SO42- |
| D.水电离出的c(H+)=10-12mol/L的溶液中:Na+、Mg2+、Cl-、SO42- |
下列无色溶液中的离子能大量共存的是()
| A.K+、Na+、MnO4-、SO42- | B.Al3+、Cl-、SO42-、AlO2- |
| C.Na+、Ba2+、Cl-、Br- | D.Fe3+、NH4+、SCN-、HCO3- |
设NA为阿伏加德罗常数的数值。下列说法错误的是( )
| A.20g重水(D2O)中含有10NA个电子 |
| B.标准状况下,22.4L一氯甲烷的分子数约为NA |
| C.4.6 g Na在氧气中完全反应生成Na2O和Na2O2,转移电子数为0.2NA |
| D.25℃时,1L pH = 14的Ba(OH)2溶液中,Ba2+ 数为NA |
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,并于10 min时达到平衡:PCl3(g)+Cl2(g)  PCl5(g) △H<0。有关数据如下:
PCl5(g) △H<0。有关数据如下:
| PCl3(g) |
Cl2(g) |
PCl5(g) |
|
| 初始浓度/(mol/L) |
2.0 |
1.0 |
0 |
| 平衡浓度/(mol/L) |
(1.6)c1 |
(0.6)c2 |
0.4 |
下列判断不正确的是()
A.10 min内,v(Cl2)=0.04 mol/(L·min)
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,
c(PCl5)<0.2 mol/L
下列反应的离子方程式书写正确的是:()
| A.氯化铝溶液中加入过量氨水:Al3+ + 4NH3•H2O |
| B.NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3- + OH- +Ba2+ ="=" H2O + BaCO3↓ |
| C.碳酸氢铵溶液和足量氢氧化钠溶液反应: NH4+ + OH - =NH3·H2O |
D.NaAlO2溶液中通入少量CO2:2A1O2_+CO2+3H2O====2Al(OH)3↓+CO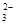 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为6NA |
| B.标准状况下,22.4L己烷中共价键数目为19NA |
| C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
| D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32- |
常温时,某无色溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该无色溶液中一定大量共存的离子组是()
| A.AlO2-、K+、NH4+、Na+ | B.I-、Ca2+、HCO3-、Na+ |
| C.MnO4-、SO42-、K+、Al3+ | D.Na+、SO42-、Cl-、NO3- |