某有机物是药物生产的中间体,其结构简式如下图,下列有关叙述不正确的是( )

| A.该有机物与浓溴水可发生取代反应 |
| B.该有机物与浓硫酸混合共热可发生消去反应 |
| C.1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH |
| D.该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀 |
已知:① 向KMnO4晶体滴加浓盐酸,产生黄绿色气体;② 向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;下列判断正确的为
| A.上述实验中,只有一个氧化还原反应 |
| B.实验①中 产物是Cl2和HMnO4 |
| C.实验①中浓盐酸不仅仅体现酸性 |
| D.实验②可证明Fe2+既有氧化性又有还原性 |
设NA为阿伏加德罗常数的值,下列说法不正确的是
| A.物质的量浓度为1 mol/L的K2SO4溶液中,含2 mol K+ |
| B.把40 g NaOH固体溶于水得到1 L溶液,所得溶液中NaOH的物质的量浓度为1 mol·L-1 |
| C.常温常压下,71 g Cl2含有2 NA个Cl原子 |
| D.标准状况下,11.2 L N2中含有的电子数为7NA |
纯二氧化硅可用下列流程制得。下列说法不正确的是
| A.X可用作木材防火剂 |
| B.步骤II的反应是Na2SiO3 + H2SO4 = H2SiO3(胶体) + Na2SO4 |
| C.步骤Ⅱ中的稀硫酸可用CO2来代替 |
| D.步骤 Ⅲ若在实验室完成,一般在蒸发皿中进行 |
用下图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列有关实验
的说法不合理的是
| A.反应一段时间,①中试管底部有少量固体生成 |
| B.②中用品红溶液验证SO2的生成 |
| C.③中用石蕊溶液检验SO2溶液的酸碱性 |
| D.向①中直接加水,观察颜色,确认CuSO4生成 |
将一小段铝片放入盛有 2 mol/L的NaOH溶液中。ⅰ.开始时,没有明显现象;ⅱ.过一会儿,有大量气泡产生;ⅲ.把点燃的木条放在试管口,有爆鸣声。下列说法不正确的是
| A.现象ⅰ、ⅱ说明NaOH溶液能溶解Al2O3 |
| B.现象ⅱ、ⅲ是因为发生了反应:2Al + 2OH- + 2H2O=2AlO2- + 3H2↑ |
| C.现象ⅰ、ⅱ,可推测家用铝制餐具不宜长时间盛放碱性食物 |
| D.上述实验说明活泼金属都具有类似的性质 |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.0.1 mol Cl2含有的氯原子数为0.1NA |
| B.3.4 g NH3含有的分子数为0.2NA |
| C.标准状况下,22.4 L H2O含有的分子数为NA |
| D.100 mL 0.1 mol/L的Na2SO4溶液中,Na+数为0.01 NA |
精制粗盐(杂质是MgCl2、CaCl2和Na2SO4),选用NaOH溶液、BaCl2溶液、Na2CO3溶液作为除杂试剂,最后用盐酸调节溶液pH,得到精制NaCl。下列说法正确的是
| A.依次向粗盐溶液中加入NaOH、Na2CO3、BaCl2 |
| B.用HNO3酸化的AgNO3溶液检验SO42-是否除尽 |
| C.除去Ca2+的主要反应是:Ca2+ + 2OH‑=Ca(OH)2↓ |
| D.调节pH后,采用蒸发浓缩结晶的方法获得精制NaCl |
某溶液中含有KCl、KBr、K2CrO4,浓度均为0.01mol/L,已知Ksp(AgCl)=1.77×10-10,Ksp(AgBr)=5.35×10-13,Ksp(Ag2CrO4)=1.12×10-12,向溶液中逐滴加入0.01mol/LAgNO3溶液时,最先产生沉淀的是( )
| A.AgCl | B.AgBr | C.Ag2CrO4 | D.同时沉淀 |
对于可逆反应:2A(g)+B(g) 2C(g) △H<0,下列各图中正确的是( )
2C(g) △H<0,下列各图中正确的是( )
A.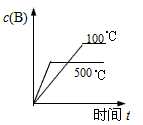 |
B.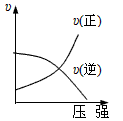 |
C.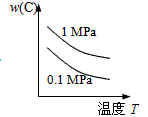 |
D.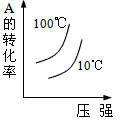 |
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。据图判断正确的是( )

| A.Ⅱ为盐酸稀释时的pH变化曲线 |
| B.a点Kw的数值比c点Kw的数值大 |
| C.b点酸的总浓度小于a点酸的总浓度 |
| D.b点溶液的导电性比c点溶液的导电性强 |
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为( )
| A.920kJ | B.557kJ | C.436kJ | D.188kJ |
反应PCl5(g) PCl3(g)+Cl2(g) ① 2HI(g)
PCl3(g)+Cl2(g) ① 2HI(g) H2(g)+I2(g) ②。在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
H2(g)+I2(g) ②。在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
| A.均增大 | B.均不变 |
| C.①增大,②不变 | D.①减小,②不变 |
向一定质量的Cu和Fe2O3的混合物中加入200mL3mol∙L-1的HCl溶液,恰好使混合物完全溶解,向所得溶液中加入KSCN溶液中,无血红色出现。若过量的CO在高温下还原此混合物,得到固体的质量为( )
| A.17.6g | B.18.4g | C.24.0g | D.条件不足无法计算 |
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
| A.0.5mol∙L-1K2SO4含有的K+数目为NA |
| B.56g铁与足量的盐酸反应时失去电子的数目为3NA |
| C.在标准状况下,22.4LCCl4中含有的分子数目为NA |
| D.在常温常压下,16gO2和O3的混合气体所含原子数目为NA |