我国拥有丰富的海洋资源,海水制盐历史悠久,早在5000年前的仰韶文化时期,先人就利用海水煮盐。为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)第①步操作的名称是 ,第②步判断BaCl2已过量的方法是 。
(2)第④步加入试剂的化学式为 。
(3)第⑤步操作所需玻璃仪器的名称是 。
(4)若第⑤步、第⑥步顺序颠倒,将对实验结果产生影响,其原因是 。
(7分)海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI===2KCl+I2。请回答下列问题:
(1)指出提取碘的过程中有关实验操作①、③的名称:________;________。
(2)在3 mL碘水中,加入1 mL四氯化碳,振荡、静置后,观察到试管里的分层现象是________。(注:如图试管中深色区为紫红色溶液)
(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出如图实验装置中的错误之处。(加热装置烧杯下已垫石棉网)
①____________________________;
②_____________________________。
(8分)某学生设计了如下实验:
 |
回答下列问题:
(1)该同学的实验目的是 ;
(2)上图括号内的操作均为 ;
(3)按此实验方案得到的NaCl固体中肯定含有 杂质(填化学式);为了解决这个问题可以向过滤得到的滤液中加入适量的 ;
某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
| 检测次数 |
溶液中检测出的物质 |
| 第一次 |
KCl、K2SO4、Na2CO3、NaCl |
| 第二次 |
KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 |
Na2SO4、KCl、K2CO3、NaCl |
(1)三次检测结果中第__________次检测结果不正确。
(2)在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子:
第一步:向溶液中滴加过量的 溶液(填化学式),其目的是检验CO32-
并将其除去;
第二步:加入 溶液(填化学式),其目的是 ;
第三步:过滤,再向滤液中加入_____________溶液(填化学式),其目的是 ;
Na2S2O3可用作照相的定影剂等。已知Na2S2O3的某些性质如下:
(1)S2O32-能被I2氧化为S4O62-; (2) 酸性条件下S2O32-迅速分解为S和SO2
Ⅰ、市售Na2S2O3中常含有SO42-, 请完成以下方案,检验其中含有的SO42-:
| 实验步骤 |
预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 |
固体完全溶解得无色澄清溶液 |
| 步骤2: |
|
| 步骤3: |
|
Ⅱ、利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度,步骤为:
① 溶液配制:称取1.0gNa2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL。
②滴定:取10.00mL 0.01mol·L-1 K2Cr2O7标准溶液,加硫酸酸化,再加过量KI溶液。
③往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32-+ I2=== S4O62-+ 2I-),记录Na2S2O3溶液用量,平行滴定3次。
(1) 步骤①中必须使用的玻璃仪器有烧杯、玻璃棒、 和 。
(2) 完成并配平步骤②中的离子反应: Cr2O72- + ( ) + I-= I2 + Cr3+ + H2O。
(3) 步骤③中,指示剂最好选用 ,该滴定应在接近中性的溶液中进行而不在强酸性溶液进行的原因是 。
(4) 若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为 。
2010年8月7日,甘肃甘南藏族自治州舟曲县发生特大泥石流,造成大量人员伤亡,其中饮用水安全在灾后重建中占有极为重要的地位,某研究小组提取三处被污染的水源进行了如下分析:并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
| 阳离子 |
K+、Na+、Cu2+、Al3+ |
| 阴离子 |
SO 、HCO 、HCO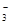 、NO 、NO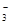 、OH- 、OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解.
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃).
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀.
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验现象写出下列物质化学式:A B C D E 。
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子形式存在。实验室从海藻中提取碘的流程如下:

(1)指出提取碘的过程中有关实验操作的名称:
①为 ,③为 ;过程②中有关反应的离子方程式是 。
(2)提取碘的过程中可供选择的有机溶剂是( )
| A.甲苯、酒精 | B.四氯化碳、苯 |
| C.汽油、醋酸 | D.汽油、酒精 |
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、 集气瓶、酒精灯、导管、圆底烧瓶、石棉网,以及必要的夹持装置、物品,尚缺少的玻璃仪器是 。
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图所示的实验装置中的错误之处: ① ,② 。

(5)海藻灼烧时需要的主要仪器是 (填写仪器名称)
有一种由CO、CO2、H2、水蒸气四种气体组成的混合气体,要证明其中含有CO和H2,可选用的仪器及药品如下:
(1)实验时,连接装置的顺序是 ;导管接口的顺序是 。
(2)装置①内发生置换反应的化学方程式是 。
(3)证明混合气体中含有氢气的实验现象是 。
(12分)某混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Al3+、Ba2+、CO32-、SO42-、Cl-、Br-。现分别取100 mL的三等份溶液进行如下实验:
①第一份加过量浓NaOH溶液加热后,收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。再向甲溶液中通人过量的CO2,生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
②第二份加足量盐酸酸化的BaC12溶液,经过滤、洗涤、干燥后,得到沉淀的质量为11.65 g,
③第三份加CCl4,滴加少量氯水,振荡后静置, CCl4层未变红色;
依据实验回答下列问题:
(1)分析上述实验,写出每一实验可以确定离子一定存在或不存在的种类。
实验①可以确定:一定存在的离子有__________,一定不存在的离子有___________;
实验②可以确定:一定存在的离子有___________________,一定不存在的离子有________;
实验③可以确定:一定不存在的离子有_____________________。
(2)试通过分析与计算,原溶液中K+的物质的量浓度为____________mol·L-1。
如图为实验室制取蒸馏水的装置示意图, 根据图示回答下列问题。

(1)指出图中的两处明显的错误: ; 。
(2)A仪器的名称是 ,B仪器的名称是 。
(3)实验时A中除加入少量自来水外,还需加入少量 ,其作用是 。
分,除标注每空分外,其余每空掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

(1)写出下列仪器的名称:
a. b. c.
(2)仪器a~e中,使用前必须检查是否漏水的有 。(填序号)
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 。将仪器补充完整后进行实验,温度计水银球的位置在____ __处.冷凝水由____________(填f或g)口通入,___ ___口流出。
(4)现需配制0.1mol·L-1NaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。(写一条)
除了图中给出的仪器和托盘天平外,为完成实验还需要的玻璃仪器有:_____ 、_
②根据计算得知,所需NaOH的质量为______________g。
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
④配制0.1 mol· L-1NaOH溶液的实验中,如果出现以下操作:
A.称量时用了生锈的砝码
B.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
C.往容量瓶转移时,有少量液体溅出
D.未洗涤溶解NaOH的烧杯
E.定容时仰视刻度线
F.容量瓶未干燥即用来配制溶液
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
上述操作中所配溶液的物质的量浓度偏大的有(填写字母)_______________
下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: 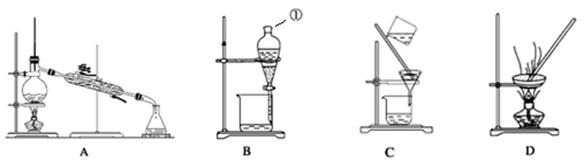
(1)装置B中①的名称是 ,若用CCl4来萃取碘水中的碘,静置后,碘的CCl4溶液在 层,呈 色;回收碘的CCl4溶液中的CCl4选择装置__ _ ___(填代表装置图的字母)。
(2)为除去粗盐中的Ca2+、Mg2+、SO以及泥沙等杂质,某同学利用相关装置设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
Ⅰ.步骤①的操作名称是 ▲ 。
Ⅱ.第④步中,加入的试剂是__ ▲____(填化学式),该步骤中涉及的离子反应方程式为:
__ ▲__ __, ▲ 。
Ⅲ.判断第⑥步盐酸已“适量”的方法是__ ▲__ __。
Ⅳ.假设按照上述流程准确规范完成后,最后得到的精盐固体的质量为m1;若没有进行第⑥步,第⑤步完成后直接进行第⑦步得到的精盐固体质量为m2;则m1__ ▲__ __m2。(填“大于”或“小于”或“等于”)
(9分)
(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示。从图中可以看出,该同学在操作时的一个错误是_________,烧杯的实际质量为___________g。
(2)指出下面三个实验中各存在的一个错误:
A.__________________________________________________________________________;
B._________________________________________________________________________;
C.__________________________________________________________________________。
为了除去氯化钠样品中的杂质碳酸钠,某兴趣小组最初设计了如下所示方案进行实验。
(1)沉淀A的化学式是________。
(2)加入过量氯化钙溶液后,分离除去沉淀A的实验操作过程是___________。
(3)他们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质。固体物质B的成分为________(用化学式表示)。
(4)他们继续探究后又提出了新的方案:将混合物溶解,滴加盐酸至不再产生气泡为止,然后加热煮沸。有关反应的化学方程式为______________。
.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下:
(1)海藻灼烧时是将带其放入 (填仪器名称)中,用酒精灯充分加热灰化。
(2)指出提取碘的过程中有关的实验操作名称:
① ② 、 。
(3)用CCl4从碘水中提取碘经过操作②后,有机溶剂在 (填“上”或“下”)层,有机层呈 色。
(4)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,
指出上图实验装置中的错误之处并改正:
①
②