江苏省泰州市姜堰区高一上学期中考试化学试卷
下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体
| A.①和② | B.①和③ | C.①和④ | D.③和④ |
在下列转化中必须加入还原剂才能实现的是
| A.CaCO3 → CO2 | B.CuSO4→Cu |
| C.H2O→H2 | D.C→CO2 |
在强碱性的无色溶液中能大量共存的离子组是
| A.K+、Mg2+、MnO4—、C1— | B.Na+、Ba2+、NO3—、C1— |
| C.Na+、H+、SO42—、C1— | D.Ca2+、K+、CO32—、NO3— |
日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是
| A.大理石雕像被酸雨腐蚀毁坏 | B.充有氢气的气球遇明火爆炸 |
| C.铁制菜刀生锈(Fe2O3·nH2O) | D.铜铸塑像上出现铜绿[Cu2(OH)2CO3] |
下列四种物质的溶液,其中一种与其它三种能发生离子反应,这种物质是
| A.BaCl2 | B.KOH | C.H2SO4 | D.Na2CO3 |
下列溶液中Cl-物质的量浓度最大的是
| A.200mL 2mol/L MgCl2溶液 | B.1000mL 2.5mol/L NaCl溶液 |
| C.300mL 5mol/L KClO3溶液 | D.250mL 1mol/L AlCl3溶液 |
下列离子方程式书写正确的是
| A.碳酸氢钠与稀硫酸反应:CO32— + 2H+= CO2↑ + H2O |
| B.澄清石灰水跟稀硝酸反应:H++OH— = H2O |
| C.氧化镁与醋酸反应:MgO+2H+=Mg2++H2O |
| D.盐酸滴到铜片上:Cu+2H+ = Cu2++H2↑ |
下列与实验相关的叙述正确的是
| A.Hg(NO3)2 溶于水,可将含有Hg(NO3)2 的废液倒入水池中,再用水冲入下水道 |
| B.用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部蒸干才停止加热 |
| C.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,必须冷却至室温才能转移到容量瓶中 |
| D.分液操作时,下层液体从分液漏斗下口放出,上层液体从下口放出到另一个烧杯 |
已知:Fe3+遇到KSCN溶液显血红色,茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是 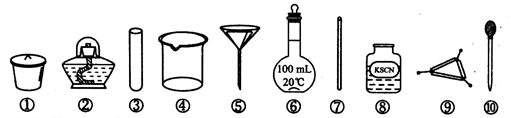
| A.将茶叶灼烧灰化,选用①、②和⑨ |
| B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ |
| C.过滤得到滤液,选用④、⑤和⑦ |
| D.检验滤液中的Fe3+,选用③、⑧和⑩ |
有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl— 完全沉淀。反应中消耗xmolH2SO4、ymolAgNO3。据此得知原混合溶液中c(Na+)为
A. mol·L—1 mol·L—1 |
B. mol·L—1 mol·L—1 |
C. mol·L—1 mol·L—1 |
D. mol·L—1 mol·L—1 |
下列说法不正确的是
| A.氧化还原反应的特征是元素化合价发生了变化 |
| B.在水溶液中能电离出H+的化合物不一定是酸 |
| C.溶液与胶体的本质区别是能否产生丁达尔现象 |
| D.因为NH3溶于水的溶液能导电,所以NH3是电解质 |
设NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,11.2L的水所含的分子数为0.5NA |
| B.16 g S4分子和16 g S8分子中所含的硫原子数相等 |
| C.0.1 mol Fe与足量稀硫酸反应失去的电子数为0.3NA |
| D.0.6mol/L的KCl溶液中含有K+个数为0.6NA |
下列说法中正确的是
| A.等温等压下,aLO2与bLO3混合后得到混合气体的体积为(a+b)L |
| B.配制100m L 0.2 mol/LCuSO4溶液,需称取CuSO4•5H2O的质量为5.0 g |
| C.在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42—的物质的量相等,则K+和Cl—的物质的量浓度一定相同 |
| D.向某溶液中滴加BaCl2溶液,产生白色沉淀,继续滴加稀盐酸沉淀不溶解,说明原溶液中一定含有SO42- |
已知反应:①Cl2 + 2KBr =" 2KCl" + Br2,
②KClO3 + 6HCl = 3Cl2 ↑+ KCl + 3H2O,
③2KBrO3 + Cl2 = Br2 + 2KClO3,
下列说法正确的是
| A.上述三个反应都有单质生成,所以都是置换反应 |
| B.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 |
| C.反应②中还原剂与氧化剂的物质的量之比为6∶1 |
| D.③中若有2molCl2反应,则KBrO3得到电子物质的量为2mol |
现有下列十种物质:
①H2 ②Cu ③Na2O ④CO2 ⑤H2SO4
⑥Ba(OH)2 ⑦红褐色的氢氧化铁胶体 ⑧碘酒 ⑨稀硝酸 ⑩Al2(SO4)3
(1)按物质的分类方法填写表格的空白处(填写序号):
| 分类标准 |
混合物 |
氧化物 |
电解质 |
| 属于该类的物质 |
|
|
|
(2)⑩在水中的电离方程式为 。
(3)写出下列物质之间反应的离子方程式:
少量的④通入⑥的水溶液 。
⑤的水溶液与⑥的水溶液混合 。
(4)质量都是10 g的HCl、NH3、CO2、H2四种气体在标准状况下,体积最小的是 ;密度最小的是__ ____。(填分子式)
(5)②与⑨发生反应的化学方程式为:3Cu + 8HNO3 (稀) = 3Cu(NO3)2 + 2NO↑ + 4H2O,__ __ __是氧化剂,__ __ __元素被氧化,参加反应的HNO3中,n(HNO3)被还原∶n(HNO3)未被还原= ,当有6.4gCu发生反应时,转移电子的物质的量为 mol。
下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: 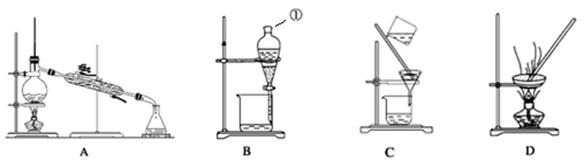
(1)装置B中①的名称是 ,若用CCl4来萃取碘水中的碘,静置后,碘的CCl4溶液在 层,呈 色;回收碘的CCl4溶液中的CCl4选择装置__ _ ___(填代表装置图的字母)。
(2)为除去粗盐中的Ca2+、Mg2+、SO以及泥沙等杂质,某同学利用相关装置设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
Ⅰ.步骤①的操作名称是 ▲ 。
Ⅱ.第④步中,加入的试剂是__ ▲____(填化学式),该步骤中涉及的离子反应方程式为:
__ ▲__ __, ▲ 。
Ⅲ.判断第⑥步盐酸已“适量”的方法是__ ▲__ __。
Ⅳ.假设按照上述流程准确规范完成后,最后得到的精盐固体的质量为m1;若没有进行第⑥步,第⑤步完成后直接进行第⑦步得到的精盐固体质量为m2;则m1__ ▲__ __m2。(填“大于”或“小于”或“等于”)
下图为实验室某浓盐酸试剂瓶上的标签,
试根据有关数据回答下列问题:
(1)该浓盐酸的物质的量浓度为_____mol·L—1。
(2)取用任意体积该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______。
| A.溶液中Cl-的数目 | B.溶液的密度 | C.溶质的物质的量 | D.溶液的浓度 |
(3)某学生欲用上述浓盐酸和蒸馏水配制450 mL物质的量浓度为0.4 mol/L的稀盐酸,该学生需要量取______mL上述浓盐酸进行配制(结果保留小数点后一位)。若用量筒量取浓盐酸时俯视观察凹液面,则所配制的稀盐酸物质的量浓度将 (填“偏高”、“偏低”或“无影响”,下同);若定容摇匀后发现液面低于刻度线,又补加水至刻度线,则所配制的稀盐酸物质的量浓度将 。
(4)取100mL 0.4 mol·L—1的盐酸与100mL 0.1 mol·L—1的AgNO3溶液混合,混合后的体积可近似为两溶液的体积之和,则所得溶液中Cl-的物质的量浓度为__ _ __。
1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将17.4gMnO2与200g 36.5%的浓盐酸(过量)完全反应,把反应后所得溶液稀释到400mL。
MnCl2+Cl2↑+2H2O。现将17.4gMnO2与200g 36.5%的浓盐酸(过量)完全反应,把反应后所得溶液稀释到400mL。
(1)请用双线桥表示该反应电子转移方向和总数 _ __。MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)计算生成Cl2的体积(折算成标准状况)为__ ____L(写计算过程,否则不得分)。
(3)计算稀释后溶液中Cl—的物质的量浓度为__ ___ mol·L—1(写计算过程,否则不得分)。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号