欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一:

方法二:

方法三:

方法四:不使用化学试剂,使用实验室常用仪器
按要求回答下列问题:
(1)方法一:加入足量的试剂A (填写A的化学式)可将HCO3— 离子转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、 、洗涤和干燥(烘干);
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要的用到的是 ,在操作2中应选择甲基橙指示剂.
(3)在方法二中计算该样品中NaHCO3的质量分数为 [用流程图中的数据m、V(HCl) 填写有关的表达式];
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是 ;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是 ,偏低的原因可能是 (均文字简述);
(6)方法四的实验原理是: (用化学方程式表示)。
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:

(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_____ ___。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是__ __。
(5)在Na2CO3溶液中存在多种离子,各种离子的浓度由大到小顺序为_ 。
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,B物质的化学式是___ ___。

铁钾矾[KxFey(SO4)m·nH2O]常用作工业媒染剂。其组成可用如下方法测定:
①准确称取2.0120g样品配成100mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.466g。
③准确量取25.00mL溶液A,加入足量的KI溶液,以淀粉为指示剂,用0.1250 mol·L-1的Na2S2O3溶液滴定,消耗8.00mL至终点(已知:I2+2Na2S2O3=2NaI+Na2S4O6)。
(1)要检验出A溶液中存在的Fe3+,可以加入 溶液。
(2)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-5 mol•L-1,应保持溶液中c(Ba2+)≥ mol·L-1。
(3)步骤③中判断滴定终点的方法是 。
(4)通过计算确定铁钾矾的组成(写出计算过程)。
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)将NaCl溶液进行电解,在电解槽的阴极区获得的产品有________________(填化学式)。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_____________________。
(3)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59 ℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:
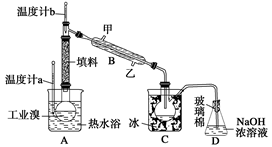
①图中仪器B的名称是 ,冷却水的出口为 (填“甲”或“乙”)。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
③C中液体的颜色为 。
④D装置的作用是 。
现有一份含Fe2O3、Al2O3、SiO2的混合物,为测定其中铁元素的含量,进行如下实验:
①称取混合物A g,滴加过量盐酸充分反应后过滤;
②在滤液中滴加过量氢氧化钠溶液充分反应后过滤;
③洗涤②所得沉淀,烘干后称重,质量为B g。
回答下列问题:
(1)步骤①中过滤所用的玻璃仪器有 ;
(2)步骤①所得滤液中铁元素的存在形式是 (填离子符号),怎样检验它的存在(写出实验操作和现象) ;
(3)步骤②中涉及的离子方程式是 、 、 ;
(4)该混合物中铁元素的质量分数为 (用含A、B的式子表示)。
有一混合物的水溶液,只可能含以下离子中的若干种:K+ 、Al3+ 、Fe3+ 、Mg2+ 、Ba2+ 、 NH4+、Cl- 、CO32-、SO42 -,现取三份100 mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加过量NaOH溶液加热后收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。
③在甲溶液中通过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
④第三份加足量BaCl2溶液后得白色沉淀,沉淀经足量盐酸洗涤干燥后质量为11.65 g。
根据上述实验回答:
(1)一定不存在的离子是___________,不能确定是否存在的离子是_____________。
(2)试确定溶液中肯定存在的阴离子及其浓度(可不填满):
离子符号______,浓度__________________;
离子符号______,浓度__________________;
(3)试确定K+ 是否存在________(填“是”或“否”),判断的理由是__________。
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu元素的相对原子质量,同时检验氯气的氧化性。

(1)为完成上述实验,正确的连接顺序为A连 ;B连 (填写连接的字母)。
(2)对硬质玻璃管里的氧化铜粉末加热前,需要的操作为 。
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是 ,对应的现象为 。
(4)丙装置的c瓶中盛放的试剂为 ,作用是 。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案,精确测量硬质玻璃管的质量为a g, 放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g ,充分反应完全后。
甲方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量。
乙方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g, 进而确定Cu的相对原子质量。
①请你分析并回答: 方案测得结果更准确。你认为不合理的方案的不足之处在 。
②按测得结果更准确的方案进行计算,Cu的相对原子质量是 。
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为: 。
(2)装置B中饱和食盐水的作用是 ;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入 。
| |
A |
B |
C |
D |
| Ⅰ |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| Ⅱ |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| Ⅲ |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)设计装置D、E的目的是 。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 。
(5)某同学建议将装置F中的药品改用足量的NaHSO3溶液吸收余氯,老师认为不妥,用总反应的离子方程式解释原因 。
下图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。

(1)若锥形瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞:
① 锥形瓶内产生的气体主要有(写化学式) 。
② 用产生的气体做氨的催化氧化实验,各仪器装置按气流方向从左到右连接顺序是(填字母)( )→( )→( )→E
③试管B中的现象为 ,反应方程式为 。
(2)若锥形瓶中盛装锌片,分液漏斗中盛装稀硫酸,当仪器连接顺序为A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是CuO、无水CuSO4粉末。
①此实验的目的是 ,
D装置的作用是 。
②为了使B中CuO反应充分,在不改变现有药品的条件下,可采取的方法有 。(写出一种即可)
③加热前必须进行的操作是 。
甲乙两同学对保存已久的Na2SO3试剂进行试验探究。取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解。
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)
(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请在答题卡上写出实验步骤、预期现象和结论。限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 |
预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置。 |
|
| 步骤2:取适量步骤1所得溶液于试管中,加入少量的 溶液。 |
若溶液褪色,说明其有 若溶液不褪色,说明其中没有 |
| 步骤3: 再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴加 溶液。 |
如果有白色沉淀生成,则说明其中有 ,已经变质。 如果没有白色沉淀生成,则说明其中没有 |
(4)经实验检验后,确实已变质,现准确测定其中Na2SO3的含量。实验如下:
①配制250ml 约0.2mol•L-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入 ,洗涤,定容,摇匀。
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05mol•L-1酸性高锰酸钾装入50ml (填酸式或碱式)滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4VmL。
③计算Na2SO3的质量分数= (只列出计算式,不要求算出结果)
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O 晶体。(图中夹持及尾气处理装置均已略去)

(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
装置B中发生反应的化学方程式是 ____________________________
(2)如果要在C处玻璃管处点燃该气体,则必须对该气体进行 ,装置E中的现象是
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法 __________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:

① 步骤I中通入Cl2的作用是____________________________。
② 步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
(一)酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。某学生用0.1032 mol·L-1的氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取25.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准NaOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________。
(2)重复三次的实验数据如下表所示:
| 实验序号 |
消耗0.1032 mol·L-1的氢氧化钠溶液的体积/mL |
待测盐酸溶液的体积/mL |
| 1 |
28.84 |
25.00 |
| 2 |
27.83 |
25.00 |
| 3 |
27.85 |
25.00 |
则待测HCl的物质的量浓度是________mol·L-1。
(3)滴定至终点的现象是 。
(4)下列操作中可能使所测盐酸的浓度数值偏低的是 。
A.碱式滴定管未用标准溶液润洗就直接注入标准液
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数
(5)若用同浓度的氨水与同浓度的盐酸混合至二者恰好完全中和时,该溶液中离子浓度大小关系为 。
(二)从海水中提取溴的工业流程如图:

(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是 。
(2)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式: 。
制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀 (填操作名称)、洗涤、烘干、称量、计算。洗涤沉淀的具体操作是 。
方案二:把一定量的样品与足量硫酸反应后,用下图所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液最好采用 。下图装置中实验仪器a的名称是 。

方案三:利用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为33.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为35.6g。

(1)若④⑤两步的实验操作太快,则会导致测定结果 (填“偏大”或“偏小”)。
(2)装置A中试剂X应选用 。
(3)E装置的作用是 。
(4)根据实验中测得的有关数据,计算纯碱样品Na2CO3的质量分数为 (结果保留小数点后一位)。
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。现有一红色粉末可能含有Fe2O3和Cu2O中的一种或两种,设计合理的实验探究样品中Fe2O3、Cu2O的存在。
查阅数据知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
请完成以下实验探究过程:
(一)提出假设
假设1:红色粉末是Fe2O3;
假设2:红色粉末是__________________;
假设3:红色粉末是___________________。
(二)设计实验方案
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是_________________________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?______________。简述你的理由________________________。
(3)若固体粉末完全溶解,向所得溶液中滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是_______________。写出实验过程中发生反应的离子方程式________________、_______________、__________________。
(4)若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为_______。
在苹果、香蕉等水果的果香中存在着乙酸正丁酯。某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯。实验步骤如下:
(一)乙酸正丁酯的制备
①在干燥的50mL圆底烧瓶中,加入13.5mL(0.15mol)正丁醇和7.2mL(0.125mol)冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石。
按下图所示安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口。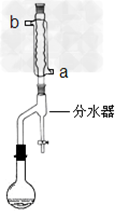
②打开冷凝水,圆底烧瓶在石棉网上用小火加热。在反应过程中,通过分水器下部的旋塞不断分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中。反应达到终点后,停止加热,记录分出的水的体积。
(二)产品的精制
③将分水器分出的酯层和反应液一起倒入分液漏斗中,先用10 mL的水洗涤,
再继续用10 mL10%Na2CO3洗涤至中性,再用10 mL 的水洗涤,最后将
有机层转移至锥形瓶中,再用无水硫酸镁干燥。
④将干燥后的乙酸正丁酯滤入50 mL 烧瓶中,常压蒸馏,收集124~126℃的
馏分,得11.6g产品。
(1)写出该制备反应的化学方程式_______________。
(2)冷水应该从冷凝管___________(填a或b)管口通入。
(3)步骤②中不断从分水器下部分出生成的水的目的是__________________。步骤②中判断反应终点的依据是_______。
(4)产品的精制过程步骤③中,洗的目的是______________________。两次洗涤完成后将有机层从分液漏斗的__________置入锥形瓶中。