(一)酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。某学生用0.1032 mol·L-1的氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取25.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准NaOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________。
(2)重复三次的实验数据如下表所示:
| 实验序号 |
消耗0.1032 mol·L-1的氢氧化钠溶液的体积/mL |
待测盐酸溶液的体积/mL |
| 1 |
28.84 |
25.00 |
| 2 |
27.83 |
25.00 |
| 3 |
27.85 |
25.00 |
则待测HCl的物质的量浓度是________mol·L-1。
(3)滴定至终点的现象是 。
(4)下列操作中可能使所测盐酸的浓度数值偏低的是 。
A.碱式滴定管未用标准溶液润洗就直接注入标准液
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数
(5)若用同浓度的氨水与同浓度的盐酸混合至二者恰好完全中和时,该溶液中离子浓度大小关系为 。
(二)从海水中提取溴的工业流程如图:
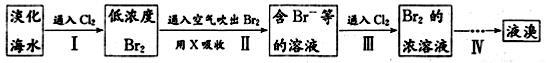
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是 。
(2)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式: 。






 粤公网安备 44130202000953号
粤公网安备 44130202000953号