某同学在实验室发现两瓶白色固体,一瓶是硫酸钠,另一瓶是碳酸钠,但均已失去标签。下面是该同学检验这两瓶固体的方法,其中不能成功检验出硫酸钠和碳酸钠的是( )
| A.分别取固体少许加入试管中,配成溶液,然后滴加氯化钡溶液 |
| B.分别取固体少许加入试管中,配成溶液,然后滴加氯化钡溶液,最后滴加盐酸 |
| C.分别取固体少许加入试管中,配成溶液,然后滴加盐酸,最后滴加氯化钡溶液 |
| D.分别取固体少许加入试管中,配成溶液,然后滴加盐酸酸化的氯化钡溶液 |
已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。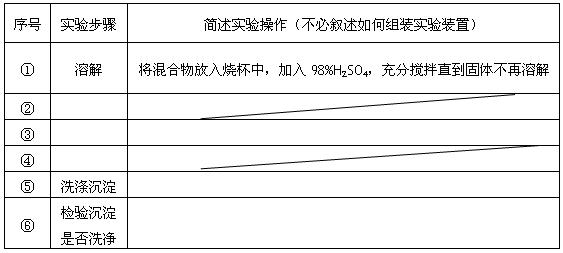
用18 mol·L-1浓硫酸配制100 mL 3.0 mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸③溶解 ④转移、洗涤 ⑤定容、摇匀
完成下列问题:
(1)所需浓硫酸的体积是________,量取浓硫酸所用的量筒的规格是________(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
(2)第③步实验的操作是________________________________。
(3)第⑤步实验的操作是________________________________。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中________________________________
B.容量瓶用蒸馏洗涤后残留有少量的水________________
C.所用过的烧杯、玻璃棒未洗涤________________
D.定容时俯视刻度线________________
实验室常利用甲醛法测定某(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO = 4H+ +(CH2)6N4+6H2O,然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤①用电子天平准确称取样品1.5000 g。
步骤②将样品溶解并冷却后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤③移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛,摇匀、静置5min,加入2滴酚酞试液,用NaOH标准溶液滴定到终点。重复步骤③操作2次。
(1)根据步骤③填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数将 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积将
(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变为 色,半分钟内不退色。
⑤滴定后俯视读数,测得样品中氮的质量分数将 (填“偏高”、“偏低”或“无影响”)。
(2)滴定结果如下表所示:
| 滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.02 |
21.04 |
| 2 |
25.00 |
2.00 |
22.00 |
| 3 |
25.00 |
0.20 |
20.21 |
若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数为 。(保留两位小数)
氯化钠样品中含有少量的Na2SO4和Na2CO3,按下列流程进行净化。
(1)请在流程中的( )中写上合适的试剂,在[ ]中写上实验操作名称。
(2)写出有关反应的化学方程式:
第②步________________
第③步________________
第⑤步________________
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:]
(1)指出上述提取碘的过程中有关实验操作的名称:
步骤③ ,步骤⑤ 。
(2)写出步骤④对应反应的离子方程式: 。
(3)提取碘的过程中,可供选择的有机试剂是 。(填编号)
| A.酒精 | B.醋酸 | C.四氯化碳 | D.苯 |
(4)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的玻璃仪器是 。
某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题
⑴第1步:灼烧。操作是将足量海带放到 灼烧成灰烬。
A.试管 B.瓷坩埚
⑵第2步:Iˉ溶液的获取。操作是将灰烬转到烧杯中,加适量蒸馏水,用 充分搅拌,煮沸, 。(填操作名称)
⑶第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用 。(填代号)A.新制氯水 B.H2O2 C.KMnO4溶液
理由是 。
⑷第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
某学生设计了下述实验室分馏石油的实验,分为五个步骤。
①将蒸馏烧瓶放在铁架台上,在蒸馏烧瓶上塞好带温度计的橡胶塞。
②连接好冷凝管,把冷凝管固定在铁架台上,将冷凝管的一端和水龙头连接,将出水口一端的橡胶管放入水槽中。
③把酒精灯放在铁架台上,根据酒精灯高度调整铁圈的高度,放好石棉网。
④向蒸馏烧瓶中放入碎瓷片,再用漏斗向烧瓶中加入原油,塞好带温度计的塞子,将牛角管接在冷凝管的末端,并深入锥形瓶中。
⑤检查气密性(利用给固定装置微热的方法)。
正确的操作顺序是( )
| A.②①③⑤④ |
| B.②③①⑤④ |
| C.①②③④⑤ |
| D.⑤④③②① |
(10分)江苏省拥有很长的海岸线,具有丰富的海洋资源,因此盐化工是本省的一个重要产业。从盐卤初步得到的光卤石(KCl·MgCl2·6H2O)晶体中,还含有约8%的NaCl。
为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
并设计出下面的实验流程:
根据他们提供的数据和实验回答下列问题:
问题1:以上实验流程中晶体X的化学式为 ,若制得的X还含有少量的可溶性杂质,可用
的方法进一步提纯。操作步骤①中趁热过滤的原因是:
问题2:工业上采用电解无水氯化镁的方法制取金属镁。
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:
(2)该小组同学采取将浓硫酸滴入浓盐酸制取氯化氢气体的方法,用下图的实验装置,在干燥的HCl气流中加热MgCl2·6H2O来得到无水MgCl2。装置中盛有浓硫酸的仪器分别
是 (填写仪器的符号),需要加热的仪器是 (同上)。
(3)为防止对环境的污染,还需要将尾气吸收,但实验室现有的仪器和试剂只有:烧杯、导管、蒸馏水、酒精、苯、四氯化碳。请你为他们设计一个尾气的吸收装置,将装置图画在方框内并在图中标明所用试剂。
某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
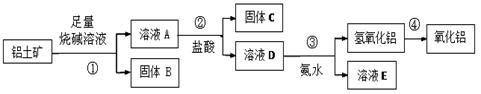
(1)固体B的主要用途有(写出1条即可) 。
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是: ; 。
(3)第③步中,生成氢氧化铝的离子方程式是 。 若往A溶液中通入足量CO2,请写出可能发生反应的离子方程式______________。
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是_____________________。
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,求该铝土矿中Al2O3的质量分数。(写出计算过程,计算结果保留一位小数)
丁烷在一定条件下裂解可按两种方式进行:
C4H10 C2H6+C2H4, C4H10
C2H6+C2H4, C4H10 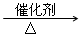 CH4+C3H6。
CH4+C3H6。
下图是某化学兴趣小组进行丁烷裂解的实验流程。(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,省略)
按上图连好装置后,需进行的实验操作有:①给D、 G装置加热;②检查整套装置的气密性;③排出装置中的空气等
⑴这三步操作的先后顺序依次是____ _____。
⑵氧化铝的作用是___ _ ,
写出甲烷与氧化铜反应的化学方程式 ;
⑶B装置所起的作用是____________ ______。
⑷若对E装置中的混合物(溴水足量),再按以下流程实验:
①操作I、操作II分别是 、 ;
②已知D的氢核磁共振谱图上只有一种峰,则D的结构简式 ;
③Na2SO3溶液的作用是 ;
(5)假定丁烷完全裂解,当(E+F)装置的总质量比反应前增加了0.7 g, G装置的质量减少了1.76 g,则丁烷的裂解产物中甲烷和乙烷的物质的量之比n (CH4) : n (C2H6) =______(假定流经D、G装置中的气体能完全反应)
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:
(1)混合物中是否存在FeCl2 ___(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4 ___(填“是”或“否”),你的判断依据是 。
(3)写出反应④的离子反应式: __ 。
(4)请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)
。
(5)把AlCl3溶液中加热浓缩蒸干,不能得到AlCl3·6H2O晶体,请你设计一个可行的简易实验方案,怎样从溶液中得到较纯的AlCl3·6H2O晶体。
。
某化学兴趣小组需制备22.4 LSO2气体(标准状况),他们依据化学方程式Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是(用离子方程式表示) 。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体(X)取样进行认真探究。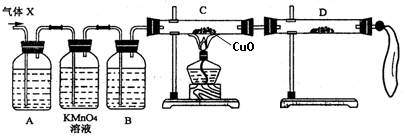
①组装好仪器后,盛放药品前,必要的一个操作是 。
②A中加入的试剂可能是 ,作用是 。
B中加入的试剂可能是 ,作用是 。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是 ,D中最好选择的试剂是 。
(3)假定气体在吸收过程吸收完全,对上述装置略加改进,可以粗略测定X气体中SO2的体积分数。改进时可选用的下列仪器为 (填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
(12分)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了如右的实验: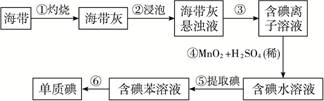
请完成下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是________________(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 E.酒精灯 F.干燥器 |
(2)步骤③的实验操作名称是_________________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是________________。
(3)步骤④反应的离子方程式是________________________________________________。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是________________________________。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:_______________。