选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.加热分解法 | C.结晶法 |
| D.分液法 E.蒸馏法 F.过滤法 |
(1)________分离饱和食盐水与沙子的混合的。
(2)________从KNO3和NaCl的混合溶液中获得KNO3。
(3)________分离水和汽油的混合物。
(4)________分离四氯化碳(沸点76.75℃)和甲苯(沸点110.6℃)的混合物。
(5)________从碘的水溶液里提取碘。
(6)________从NaCl与NH4HCO3固体混合物中得到NaCl。
照相用的废定影液中含有Na+、[Ag(S2O3)2]3-、Br-等离子。某研究性学习小组拟通过下列实验程序,对某照相公司的废定影液进行实验处理,回收其中的银和溴。(已知:4H++2 [Ag(S2O3)2]3-= Ag2S↓+3S↓+3SO2↑+SO42-+2H2O)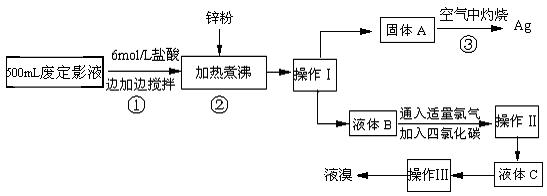
⑴操作Ⅲ的名称是 ▲ ;操作Ⅱ需要的主要玻璃仪器有 ▲ 。
⑵加入锌粉的目的是将少量溴化银中的银还原出来,该反应的离子反应方程式为 ▲。
⑶液体B中除含有Br-,还有SO42-,检验溶液中存在SO42-的操作是 ▲ 。
⑷步骤③实验操作时,也常采用加入适量硝酸钾加盖后再灼热的方法,推测加硝酸钾的目的可能是 ▲ 。
⑸通过上述回收银的流程中,从绿色化学的要求看,存在的不足为 ▲ 。
粗食盐中除含有钙离子(CaCl2)、镁离子(MgCl2)、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯 ;②固定铁圈位置 ;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌; ⑤停止加热。其正确的操作顺序为 。
何时停止加热 。
(2)如何运用最简方法检验溶液中有无SO42-离子,所用试剂 。如何检验SO42-离子是否除净简单操作为 。
(3)粗食盐中除去钙离子所用试剂为 。化学反应方程式
(4)粗食盐中除去镁离子所用试剂为 。化学反应方程式
( 10分)分别除去下列各物质中的杂质,在空白处写出所用试剂的化学式
(1)除去MgCl2中混有的少量MgCO3,可选用试剂
(2)除去FeCl3溶液中混有的少量FeCl2 ,可选用试剂
,可选用试剂
(3)除去SiO2中混有的少量CaO,可选用试剂
(4)除去FeCl2溶液中混有的少量Cu2+,可选用试剂
(5 )除去Fe粉中混有的少量铝粉,可选用试剂
)除去Fe粉中混有的少量铝粉,可选用试剂
对于混合物的分离或者提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、加热分解 等。下列各组混合物的分离或提纯应采用什么方法?
等。下列各组混合物的分离或提纯应采用什么方法?
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用 方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2)提取碘水中的碘,用 方法。
(3)除去食盐溶液中的水,可采用 方法。
(4)淡化海水,可采用 方法。
(5)除去氧化钙中的碳酸钙,可用 方法。
按下列要求回答
(1)除去下列不纯物质中的少量杂质(括号内为杂质),请填入适当的试剂
①Fe(Al) ②NH3(H2O)
③NO(NO2) ④NaCl溶液(Na2SO4)
(2)实验室配制100mL0.5mol·L‑1的Na2CO3溶液,回答下列问题:
①应用托盘天平称取碳酸钠粉末 g。
②配制时应选用的仪器有500mL溶量瓶,托盘天平、烧杯、药匙、 。
③若实验时遇到下列情况,所配溶液的浓度偏大的是 。
| A.加水定容时超过刻度线,又吸出少量至刻度线 |
| B.没有将洗涤液转入容量瓶 |
C.容量瓶洗涤后内壁有水珠而未作干燥 处理 处理 |
| D.定容时府视刻度线 |
(6分)有一瓶澄清的溶液,其中可能含NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、Cl-、I-,取该溶液进行如下实验:
⑴用pH试纸检验,表明溶液呈强酸性;
⑵取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置CCl4层呈紫红色;
⑶取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
⑷取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
⑸将⑶得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:
在溶液中肯定存在的上述离子有 ,肯定不存在的上述离子有 。
(共5分)分离沸点不同但又互溶的液体混合物,常用的方法是 ;分离固液混合物的常用的方法是 ;分离两种溶解度相差很大的溶质的溶液时,常用的方法是 ;萃取的条件是 。
有一固体混合物可能含有氯化铁、亚硝酸钠、硝酸银、氯化铜、硝酸钠、熟石灰和氯化铵等7种物质。将混合物溶于水得白色沉淀和无色溶液。白色沉淀可溶于氨水中。无色溶液与强碱共热放出的气体可使酚酞变红。无色溶液也可使酸性高锰酸钾溶液褪色。无色溶液受热时可放出氮气。
已知:Ksp(AgNO2)=6.0×10-4;Ksp(AgCl)=1.56×10-10
回答下列问题(用化学符号回答):
(1)该固体混合物中肯定存在的物质是________________,肯定不存在的物质是_______________。
(2)混合物溶于水时所得的白色沉淀中肯定有________________。该沉淀溶于氨水的离子方程式为_______________________________________。
(3)无色溶液中,使酸性高锰酸钾褪色的物质是___________________。
(4)写出无色溶液受热时放出氮气的化学方程式__________________。
某溶液中含有K+、NH+4、Al3+、OH-、AlO-2、SO2-4、CO2-3、SiO2-3、Cl-等离子中的某几种。现进行如下实验:①取少量溶液逐滴加入盐酸,先无明显现象,当盐酸加到一定体积后开始产生沉淀并逐渐增多,在沉浣不再增加后又产生一种无色气体,在气体不再产生后沉淀开始溶解,直至最后完全消失;
②取①所得溶液,加入Ba(OH)2溶液,无明显现象。
(1)原溶液中肯定存在的离子是 ;肯定不存在的离子是 。
(2)已知用一定体积的原溶液进行实验①时,需消耗0.2 mol/L的盐酸5 mL,这时向所得溶液中加入足量的硝酸银溶液可得沉淀0.187g,则原溶液中 (填“有”“没有”或“不确定”)Cl-。
某溶液中含有K+、NH+4、Al3+、OH-、AlO-2、SO2-4、CO2-3、SiO2-3、Cl-等离子中的某几种。现进行如下实验:①取少量溶液逐滴加入盐酸,先无明显现象,当盐酸加到一定体积后开始产生沉淀并逐渐增多,在沉浣不再增加后又产生一种无色气体,在气体不再产生后沉淀开始溶解,直至最后完全消失;
②取①所得溶液,加入Ba(OH)2溶液,无明显现象。
(1)原溶液中肯定存在的离子是 ;肯定不存在的离子是 。
(2)已知用一定体积的原溶液进行实验①时,需消耗0.2 mol/L的盐酸5 mL,这时向所得溶液中加入足量的硝酸银溶液可得沉淀0.187g,则原溶液中 (填“有”“没有”或“不确定”)Cl-。
(Ⅰ)有一包白色粉末,可能含有NaHSO4 KHCO3 Ba(NO3)2 CaCl2 NaNO3 MgSO4 中的一种或几种。
(1)取少量粉末投入水中,既有气体又有沉淀产生;
(2)过滤,取少量滤液,加入AgNO3溶液,无沉淀产生;
(3)再取少量滤液,加入NaOH溶液,也无沉淀产生。
推断白色粉末中一定有_______ ,一定没有_______,不能肯定有没有的是
________。
(Ⅱ)现有A、B、C、D、E五种盐溶液,分别由K+、NH4+、Ag+、Ba2+、 Al3+、Cl-、Br-、CO32-、SO42-、NO3-中的阳离子与阴离子各一种组成(五种盐所含阴、阳离子各不相同)。
已知:①A+B→白↓;②A+C→白↓;③A+D→白↓;④B+C+H2O→白↓+气体;⑤A的溶液呈中性;⑥B的溶液中c(OH-)>c(H+);⑦C、D、E三种溶液的pH<7.根据以上事实,回答下列问题:
⑴写出化学式:C D E
⑵用离子方程式表示:B的溶液中c(OH-)>c(H+)的原因。
I.常温下浓度均为0.l mol/L的下列溶液:①Na2CO3溶液②NaHCO3溶液③盐酸④氨水
回答下列问题。
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 。
(2)四种溶液中对水的电离抑制作用最大的是 ;比较①、②溶液,pH较大的是 。
(3)在溶液④中加入NH4Cl固体,NH+4浓度与OH-浓度的比值将____(填“变大”、“变小”、“不变”)
II.有一瓶无色澄清溶渡,其中可能含有:NH+4、K+、Mg2+、Al3+、Fe2+、NO-3、Cl-、SO2-4、CO2-3取该溶液进行下列实验:
(1)取部分溶液,向其中逐滴滇入Ba(OH
 )2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。
)2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。
(2)取(I)反应后过滤所得沉淀和滤液,在沉淀中加入稀盐酸后,沉淀不减少。将滤液分为两等份,一份加热,未产生刺激性气味的气体;另一份如HNO3酸化时有白色沉淀产生,继续加HNO3,沉淀又消失,再加AgNO3没有变化。
根据以上事实确定:该溶液中肯定 存在的离子有 ;
存在的离子有 ;
肯定不存在的离子有____ 。
物质的分离是化学研究中常用的方法,填写下列物质分离时需使用的方法(不必叙述操作细节)
(1)两种互不相溶的液体的分离 。
(2)固体和液体的分离 。
(3)含固体溶质的溶液中除去部分溶剂 。
(4)胶体中分离出可溶电解质 。
(5)几种沸点相差较大的互溶液体的分离 。