(6分)如图为实验室分离水和乙醇的装置图,根据图示回答下列问题。

(1) 图中的两处明显的错误是:
_________________________________,
_________________________________。
(2) A仪器的名称是____________,B仪器 
的名称是_______________。
(3) 实验时向A中加入少量碎瓷片的作用是:
____________________________________________________。
(4)实验后锥形瓶中所收集到的物质为____________。
填空题
(1)下图所示是分离混合物时常用的仪器,回答下列问题:
①写出仪器A、C、E的名称 、 、
②分离以下混合物应该主要选用上述什么仪器?(填字母符号)
A.粗盐和泥沙: B.花生油和水:
(2)写出下列物质溶于水时的电离方程式:
①Fe2(SO4)3
②NaHSO4
③KMnO4
在锥形分液漏斗中加入10 mL 色碘水,然后再注入4 mL CCl4,盖好玻璃塞,按操作规则反复振荡后静置观察到的现象是:
操作完毕后,油层(即CCl4层)应从锥形分液漏斗的 口(填“上”或“下”)放出或倒出,为得到碘并回收CCl4可用 法。
某校实验小组的同学用实验的方法区别稀盐酸和稀硫酸钠溶液(记作M、N),请你一同参与。
⑴甲组同学向M、N中分别加入少量的铁粉,观察到M中产生大量无色气泡,则M中发生反应的化学方程式为 。
⑵乙组同学向M、N中分别滴加Na2CO3溶液,发现M也有无色气泡产生,N没有气泡产生,则M中发生反应的化学反应方程式为 。
⑶丙组同学向M、N中分别加入滴加BaCl2溶液,N中出现的现象是 。
⑷丁组同学用了下列试剂中的一种也将M、N区别开来,这种试剂是 (填序号)
①酚酞试液 ②硫酸铜溶液 ③氯化钠溶液 ④pH试纸
四只失去标签的试剂瓶中分别盛有NaCl溶液、NaNO3溶液、Na2CO3溶液和Na2SO4溶液,就如何检验这四种溶液做如下实验:先用四只试管分别取四种溶液各1mL, ① 在四只试管中分别滴入过量的同一种试剂,根据反应现象检验出一种物质;② 在剩余的三只试管中分别滴入第二种试剂,又检验出一种物质;③ 在剩余的两只试管中分别滴入第三种试剂,检验出第三种物质;④在三次实验中都没有明显现象的是第四种物质。请回答:
(1)①中加入的试剂的名称是 ;
(2)②中检验出的物质是 (写化学式);
(3)③中反应的现象是 。
选择适当的试剂,除去以下物质中的杂质:
(1)苯中的甲苯 ;
(2)乙醇中的水 ;
(3)乙酸乙酯中的乙酸 。
(1).现有以下物质①NaCl溶液 ②干冰 ③硫酸 ④铜 ⑤BaSO4固体 ⑥蔗糖 ⑦酒精 ⑧熔融状态的KNO3,其中属于电解质的是: ;属于非电解质的是: ;能导电的是: 。(均填序号)
(2).选择下列实验方法分离物质,将分离方法的字母填在横线上。
| A.萃取分液 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.过滤 |
①分离粗盐中混有的泥沙______。 ②分离碘和水的混合物______。
③分离水和汽油的混合物______。 ④分离酒精和水的混合物______。
(3).离子方程式BaCO3+2H+ ="=" CO2↑+H2O+Ba2+中的H+不能代表的物质是_____________(填序号)①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
(4)取少量Fe(OH)3胶体置于试管中,向试管中滴加一定量稀盐酸,边滴边振荡,可以看到溶液先出现红褐色浑浊,接着红褐色浑浊逐渐变浅,最终又得到黄色的FeCl3溶液,先出现红褐色浑浊的原因: ,又得到黄色的FeCl3溶液的化学方程式为: 。
下列物质的转化或分离是用哪种方法实现的?
| A.溶解 | B.裂解 | C.分馏 | D.裂化 E.干馏 |
F.蒸馏 G.电解 H.过滤 I.萃取
请将所选方法的字母代号填在横线上(每一项只填写一种最主要的方法)。
(1)把煤转化为焦炉气、煤焦油和焦炭等
(2)从原油中分离出汽油、煤油、柴油等
(3)将海水淡化
(4)除去粗盐溶液中的泥沙
(5)从海水得到的无水MgCl2中提取金属镁
(6)海水提溴获得的溴水中,提取溴单质
海带中含有丰富的碘。为了从海中提取碘,某研究性学习小组设计并进行了以下实验:
现有下列仪器,请按要求填写以下空白:
(1)其中适用于物质分离的仪器有______________(填名称),使用前需要检验是否漏水的有 (填序号)。
(2)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 E.酒精灯 F.干燥器 |
(3)步骤③除铁架台、烧杯外,还需用到的仪器有 ;
(4)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 ,上图中还缺少的玻璃仪器是 。
(5)步骤⑤中某学生选择用苯来提取碘的理由是 。
某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下:
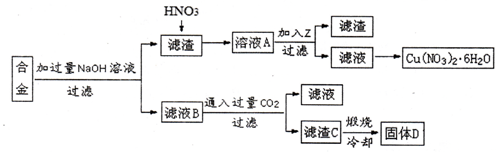
已知:Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7。
(1)写出合金中加入NaOH溶液后所发生的离子反应方程式 。
(2)写出滤液B中通入过量CO2的化学方程式 。
(3)加入Z的作用是调节溶液的pH,除去溶液中的Fe3+,pH范围应为 ;下列可作为试剂z的是 。(填序号)
a.铜粉 b.氨水 c.氧化铜 d. 硫酸铜
(4)某同学为了测定硝酸铜晶体的结晶水含量,完成操作步骤:称量样品、加热、 、称量CuO质量、 、计算。
(5)滤渣C的质量是10g,煅烧后得到固体D6.90g,则滤渣C中氢氧化铝的质量分数为 。(保留两位小数)
(6)按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高,可能的原因是 。(写一条即可)
工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)滤液X中含有的金属阳离子是______________(填离子符号)。
(2)步骤Ⅲ中可选用________调节溶液的pH(填字母)。
| A.稀硫酸 | B.氨水 |
| C.氢氧化钠溶液 | D.高锰酸钾溶液 |
(3)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是______________。
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是__________________________。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为_________________________。
选择下列实验方法分离物质,将分离方法的序号填在横线上。A 萃取分液 B 升华 C 结晶 D 分液 E 蒸馏 F 层 析 G 过滤
(1)_________分离饱和食盐水与沙子的混合物。
(2)_________从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)_________分离水和汽油的混合物。
(4)_________分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
用“化学反应气体体积测定仪”测定1mol氢气的体积时,要三次用到注射器,其中两次是抽气调压,还有一次是 。
通常用小苏打的悬浊液除去CO2中的HCl,反应的离子方程式为:
,不能用NaOH溶液的原因是
,也不能用Na2CO3的原因是
(用离子方程式表示原因)。