选用一种试剂除去下列物质中的杂质(括号中为杂质),并写出其化学方程式或离子方程式。可供选用的试剂:
| A.氢氧化钠溶液 | B.水 | C.二氧化碳气体 | D.铁粉E铜粉,(题中填入试剂代号) |
(1)Na2CO3 (Na2O2) 除杂剂 ,化学方程式 ;
(2)FeCl2溶液(FeCl3) 除杂剂 ,离子方程式 ;
(3)Fe粉(Al粉) 除杂剂 ,离子方程式 ;
(4)NO(NO2)除杂剂___________,化学方程式__________________________________。
选择下列实验方法分离物质,将分离方法的序号填在横线上:
A 过滤 B.结晶 C.分液 D.蒸馏 E.萃取分液 F.升华 G.渗析
(1) 分离水和苯的混合物;
(2) 分离饱和氯化钾溶液和沙子的混合物;
(3) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(4) 分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物;
(5) 从碘水中提取碘单质。
(每空1分,共5分).可用于分离或提纯物质的方法有:①过滤②蒸馏③加热④分液(填序号)
(1)除去石灰水中悬浮的CaCO3颗粒
(2)除去NaCl晶体中混有的碘单质
(3)分离石油中各不同沸点范围的成分
(4)分离水和苯的混合物
(5)分离CCl4(沸点76.75℃)和甲苯(沸点110.6℃)____________。
草酸(乙二酸)可做还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如图。

回答下列问题:
(1)CO和氢氧化钠在一定条件下合成甲酸钠的化学反应方程式为 。
(2)该制备工艺中有两次过滤操作,过滤操作②的滤液是 ,滤渣是 。
(3)工艺过程中③和④的目的是 。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸,该方案的缺点是产品不纯,其中含有的杂质主要是 。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定,称量草酸成品0.250g溶于水,用0.05000mol/L的酸性高锰酸钾溶液滴定,至浅红色不消退,消耗高锰酸钾溶液15.00mL,反应的离子方程式为 ;列式计算该成品的纯度 。
分离沸点不同但又互溶的液体混合物,常用的方法是 ;分离固液混合物的常用的方法是 ;分离两种溶解度相差很大的溶质的溶液时,常用的方法是 ;萃取的条件是 。
填空题
(1)下图所示是分离混合物时常用的仪器,回答下列问题:
①写出仪器A、C、E的名称 、 、
②分离以下混合物应该主要选用上述什么仪器?(填字母符号)
A.粗盐和泥沙: B.花生油和水:
(2)写出下列物质溶于水时的电离方程式:
①Fe2(SO4)3
②NaHSO4
③KMnO4
某校实验小组的同学用实验的方法区别稀盐酸和稀硫酸钠溶液(记作M、N),请你一同参与。
⑴甲组同学向M、N中分别加入少量的铁粉,观察到M中产生大量无色气泡,则M中发生反应的化学方程式为 。
⑵乙组同学向M、N中分别滴加Na2CO3溶液,发现M也有无色气泡产生,N没有气泡产生,则M中发生反应的化学反应方程式为 。
⑶丙组同学向M、N中分别加入滴加BaCl2溶液,N中出现的现象是 。
⑷丁组同学用了下列试剂中的一种也将M、N区别开来,这种试剂是 (填序号)
①酚酞试液 ②硫酸铜溶液 ③氯化钠溶液 ④pH试纸
选择适当的试剂,除去以下物质中的杂质:
(1)苯中的甲苯 ;
(2)乙醇中的水 ;
(3)乙酸乙酯中的乙酸 。
下列物质的转化或分离是用哪种方法实现的?
| A.溶解 | B.裂解 | C.分馏 | D.裂化 E.干馏 |
F.蒸馏 G.电解 H.过滤 I.萃取
请将所选方法的字母代号填在横线上(每一项只填写一种最主要的方法)。
(1)把煤转化为焦炉气、煤焦油和焦炭等
(2)从原油中分离出汽油、煤油、柴油等
(3)将海水淡化
(4)除去粗盐溶液中的泥沙
(5)从海水得到的无水MgCl2中提取金属镁
(6)海水提溴获得的溴水中,提取溴单质
海带中含有丰富的碘。为了从海中提取碘,某研究性学习小组设计并进行了以下实验:
现有下列仪器,请按要求填写以下空白:
(1)其中适用于物质分离的仪器有______________(填名称),使用前需要检验是否漏水的有 (填序号)。
(2)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 E.酒精灯 F.干燥器 |
(3)步骤③除铁架台、烧杯外,还需用到的仪器有 ;
(4)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 ,上图中还缺少的玻璃仪器是 。
(5)步骤⑤中某学生选择用苯来提取碘的理由是 。
某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下:
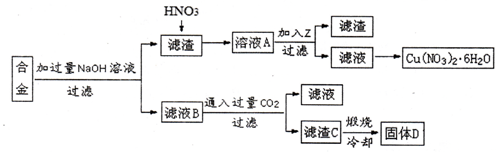
已知:Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7。
(1)写出合金中加入NaOH溶液后所发生的离子反应方程式 。
(2)写出滤液B中通入过量CO2的化学方程式 。
(3)加入Z的作用是调节溶液的pH,除去溶液中的Fe3+,pH范围应为 ;下列可作为试剂z的是 。(填序号)
a.铜粉 b.氨水 c.氧化铜 d. 硫酸铜
(4)某同学为了测定硝酸铜晶体的结晶水含量,完成操作步骤:称量样品、加热、 、称量CuO质量、 、计算。
(5)滤渣C的质量是10g,煅烧后得到固体D6.90g,则滤渣C中氢氧化铝的质量分数为 。(保留两位小数)
(6)按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高,可能的原因是 。(写一条即可)
工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)滤液X中含有的金属阳离子是______________(填离子符号)。
(2)步骤Ⅲ中可选用________调节溶液的pH(填字母)。
| A.稀硫酸 | B.氨水 |
| C.氢氧化钠溶液 | D.高锰酸钾溶液 |
(3)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是______________。
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是__________________________。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为_________________________。
选择下列实验方法分离物质,将分离方法的序号填在横线上。A 萃取分液 B 升华 C 结晶 D 分液 E 蒸馏 F 层 析 G 过滤
(1)_________分离饱和食盐水与沙子的混合物。
(2)_________从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)_________分离水和汽油的混合物。
(4)_________分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
用“化学反应气体体积测定仪”测定1mol氢气的体积时,要三次用到注射器,其中两次是抽气调压,还有一次是 。