在蒸馏实验中,下列叙述不正确的是
| A.蒸馏烧瓶可直接加热 | B.在蒸馏烧瓶中放入几粒沸石,防止暴沸 |
| C.冷水从冷凝管下口入,上口出 | D.收集蒸馏水时,应弃去开始馏出的部分液体 |
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物.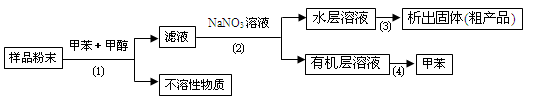
下列说法错误的是
| A.步骤(1)需要过滤装置 | B.步骤(2)需要用到分液漏斗 |
| C.步骤(3)需要用到坩埚 | D.步骤(4)需要蒸馏装置 |
工业上利用NaOH溶液来吸收、分离并利用CO2,其基本过程如下图所示(部分条件及物质未标出):

下列有关该方法的叙述中不正确的是( )
| A.生产过程中,可循环利用的物质有CaO和NaOH |
| B.该方法涉及了化合、分解和复分解等反应类型 |
| C.该方法通过化学变化,分离、提纯并利用CO2,可以减少碳的排放 |
| D.“反应分离”环节中,分离物质的基本操作是蒸发、结晶 |
下列除杂试剂(括号内为杂质)选择正确的是( )
| A.CO2(SO2):澄清石灰水 | B.CO2(CO):通入氧气,并加热 |
| C.Cl2(HCl):饱和碳酸钠溶液 | D.Fe(Al):烧碱溶液 |
为检验某溶液中是否含有SO42-、NH4+、Cl-、Fe3+等四种离子,某同学进行了下图所示的实验操作,已知检验过程中产生的气体能使湿润红色石蕊试纸变蓝。由该实验能得到的正确结论是( )

| A.原溶液中一定含有SO42- | B.原溶液中一定含有NH4+ |
| C.原溶液中一定含有Cl- | D.原溶液中一定含有Fe3+ |
对于某些离子的检验及结论一定正确的是( )
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
海水开发利用的部分过程如图所示。下列说法错误的是( )

| A.向苦卤中通入Cl2,目的是为了提取溴 |
| B.除去粗盐中的SO42-杂质,可以选择BaCl2等试剂 |
| C.工业生产常选用Ca(OH)2作为沉淀剂 |
| D.电解法制取金属镁时,原料一般是灼烧Mg (OH)2得到的MgO |
要证明氯乙烷中氯元素的存在可进行如下操作,其中顺序正确的是( )
①加入AgNO3溶液;②加入NaOH溶液;③加热;④加入蒸馏水;⑤加入HNO3酸化
| A.②③⑤① | B.④③⑤① | C.④①⑤ | D.②③①⑤ |
下列离子的检验方法正确的是
A.某溶液 有白色沉淀,说明原溶液中有Cl- 有白色沉淀,说明原溶液中有Cl- |
B.某溶液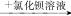 有白色沉淀,说明原溶液中有SO42- 有白色沉淀,说明原溶液中有SO42- |
C.某溶液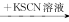 无明显变化 无明显变化 溶液变红色,说明原溶液中有Fe2+ 溶液变红色,说明原溶液中有Fe2+ |
D.某溶液 生成无色无味气体,说明原溶液中有CO32- 生成无色无味气体,说明原溶液中有CO32- |
只用一种试剂就可将AgNO3、KSCN和H2SO4、NaOH四种无色溶液区分,这种试剂
是
| A.Fe(NO3)3溶液 | B.FeCl2溶液 | C.BaCl2溶液 | D.FeCl3溶液 |
纯碱和小苏打都是白色晶体,在日常生活中都可以找到.若要在家中将它们区分开来,下面的方法中可行的是
| A.分别放在炒锅中加热,观察是否有残留物 |
| B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色 |
| C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀 |
| D.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 |
某溶液含有K+、Fe3+、SO42-、CO32-、I-中的一种或几种。取样,滴加KSCN溶液后显红色。为确定该溶液的组成,还需检验的离子是
| A.K+ | B.I- | C.SO42- | D.CO32- |
对于某些离子的检验及结论一定正确的是( )
| A.某物质进行焰色反应时呈现黄色,则该物质中一定含有Na+ |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42﹣ |
| C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |