按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物.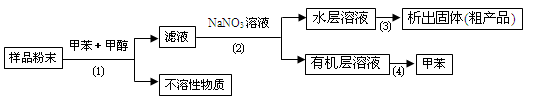
下列说法错误的是
| A.步骤(1)需要过滤装置 | B.步骤(2)需要用到分液漏斗 |
| C.步骤(3)需要用到坩埚 | D.步骤(4)需要蒸馏装置 |
对于某些离子的检验及结论一定正确的是( )
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
已知:Na2SO3 + H2O + I2=Na2SO4 + 2HI。现有一无色溶液,可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是
①肯定不含Cu2+;②肯定不含I-;③肯定含有SO32-;④可能含有I-。
| A.①③ | B.①③④ | C.①② | D.②③④ |
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 |
实验 |
现象 |
结论 |
| A |
在溶有AlCl3和MgCl2的溶液中逐滴加入NaOH溶液至过量 |
先生成白色沉淀,后沉淀部分溶解 |
金属性:Na>Mg>Al |
| B |
向某废液中先加入烧碱溶液,后加入葡萄糖溶液 |
无砖红色沉淀产生 |
废液中不含Cu2+ |
| C |
向盛有Fe(NO3)2溶液的试管中滴入H2SO4溶液 |
试管口出现红棕色气体 |
溶液中NO3-被Fe2+还原为NO2 |
| D |
加热分解钠盐X,将产生的气体通入硝酸酸化的BaCl2溶液中 |
实验开始立即产生白色沉淀 |
X可能是NaHCO3 |
只用一种试剂可以区别Na2SO4、MgCl2、FeCl2、A12(SO4)3、CuSO4五种溶液,这种试剂是
| A.氨水 | B.NaOH溶液 | C.硫酸 | D.NaNO3溶液 |
下列除杂方案正确的是
| 选项 |
被提纯的物质 |
杂质 |
除杂试剂 |
除杂方法 |
| A |
CO(g) |
CO2(g) |
饱和NaHCO3溶液、浓硫酸 |
洗气 |
| B |
FeCl2(aq) |
CuCl2 |
铁粉 |
过滤 |
| C |
Cl2(g) |
HCl(g) |
NaOH溶液、浓硫酸 |
洗气 |
| D |
NaHCO3(aq) |
Na2CO3(aq) |
盐酸 |
— |
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的是( )

| A.用装置甲制取氯气 |
| B.用装置乙除去氯气中混有的少量氯化氢 |
| C.用装置丙分离二氧化锰和氯化锰溶液 |
| D.用装置丁蒸干氯化锰溶液制MnCl2•4H2O |
下列离子的检验方法正确的是
A.某溶液 有白色沉淀,说明原溶液中有Cl- 有白色沉淀,说明原溶液中有Cl- |
B.某溶液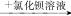 有白色沉淀,说明原溶液中有SO42- 有白色沉淀,说明原溶液中有SO42- |
C.某溶液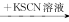 无明显变化 无明显变化 溶液变红色,说明原溶液中有Fe2+ 溶液变红色,说明原溶液中有Fe2+ |
D.某溶液 生成无色无味气体,说明原溶液中有CO32- 生成无色无味气体,说明原溶液中有CO32- |
只用一种试剂就可将AgNO3、KSCN和H2SO4、NaOH四种无色溶液区分,这种试剂
是
| A.Fe(NO3)3溶液 | B.FeCl2溶液 | C.BaCl2溶液 | D.FeCl3溶液 |
纯碱和小苏打都是白色晶体,在日常生活中都可以找到.若要在家中将它们区分开来,下面的方法中可行的是
| A.分别放在炒锅中加热,观察是否有残留物 |
| B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色 |
| C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀 |
| D.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 |
某溶液含有K+、Fe3+、SO42-、CO32-、I-中的一种或几种。取样,滴加KSCN溶液后显红色。为确定该溶液的组成,还需检验的离子是
| A.K+ | B.I- | C.SO42- | D.CO32- |
下列除去杂质(括号中的物质为杂质)的方法中,不正确的是
| A.FeCl3溶液(FeCl2):通入适量Cl2 |
| B.Fe2O3固体(Al2O3):加入足量的盐酸,过滤 |
| C.CO气体(CO2):通过NaOH溶液洗气后干燥 |
| D.Cl2气体(HCl):通过饱和NaCl溶液洗气后干燥 |