下列实验操作中错误的是
| A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.向碘水中加入适量酒精,可以将碘单质萃取出来 |
| D.蒸发时,当溶液中出现大量晶体时,停止加热余热蒸干 |
在粗盐的提纯实验中,下列说法正确的是
| A.该实验得到的NaCl中无其他任何杂质 |
| B.检验所得NaCl中是否混有BaCl2,可用AgNO3溶液检验 |
| C.该实验基本操作分为溶解、过滤和蒸发三个步骤 |
| D.除去杂质时,不必考虑所加试剂的顺序 |
海水开发利用的部分过程如图所示。下列说法错误的是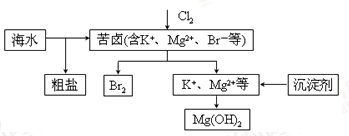
| A.向苦卤中通入Cl2是为了提取溴 |
| B.粗盐可采用除杂和重结晶等过程提纯 |
| C.工业生产中常选用NaOH作为沉淀剂 |
| D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物.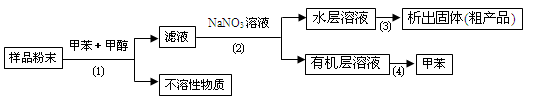
下列说法错误的是
| A.步骤(1)需要过滤装置 | B.步骤(2)需要用到分液漏斗 |
| C.步骤(3)需要用到坩埚 | D.步骤(4)需要蒸馏装置 |
对于某些离子的检验及结论正确的是
| A.向某溶液中滴加NaOH溶液并加热,用湿润的蓝色石蕊试纸于试管口以检验NH4+ |
| B.加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失,一定有SO42- |
| C.某待测液焰色反应呈黄色,则待测液中一定不含有K+ |
| D.某溶液中加入KSCN后,溶液无变化,再加入H2O2后,溶液变成血红色,说明原溶液中一定含有Fe2+ |
下列说法正确的是
| A.FeCl3溶液需存放在加有少量铁粉的试剂瓶中,防止变质 |
| B.食盐水中Ca2+、SO42-等杂质的去除,应先加Na2CO3溶液,后加BaCl2溶液 |
| C.用四氯化碳来萃取碘水中的I2,有机层应从分液漏斗的下端放出 |
| D.用BaCl2溶液来检验暴露在空气中的Na2SO3样品是否变质 |
用下列实验装置进行相应实验,装置正确且能达到实验目的的是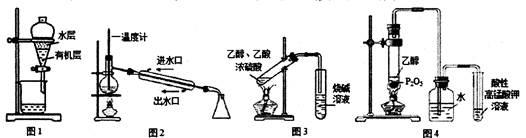
| A.用图1所示装置分离用苯萃取碘水后已分层的有机层和水层 |
| B.用图2所示装置进行石油的分馏 |
| C.用图3所示装置制备少量的乙酸乙酯 |
| D.用图4所示装置制取乙烯并验证其易被氧化 |
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 |
实验 |
现象 |
结论 |
| A |
在溶有AlCl3和MgCl2的溶液中逐滴加入NaOH溶液至过量 |
先生成白色沉淀,后沉淀部分溶解 |
金属性:Na>Mg>Al |
| B |
向某废液中先加入烧碱溶液,后加入葡萄糖溶液 |
无砖红色沉淀产生 |
废液中不含Cu2+ |
| C |
向盛有Fe(NO3)2溶液的试管中滴入H2SO4溶液 |
试管口出现红棕色气体 |
溶液中NO3-被Fe2+还原为NO2 |
| D |
加热分解钠盐X,将产生的气体通入硝酸酸化的BaCl2溶液中 |
实验开始立即产生白色沉淀 |
X可能是NaHCO3 |
下列有关离子的检验方法和判断正确的是
| A.向某溶液中滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+ |
| B.向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含Ag+ |
| C.向某溶液中滴加足量稀HCl,产生气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32- |
| D.用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色,说明原溶液中不含K+ |
下列除杂方案正确的是
| 选项 |
被提纯的物质 |
杂质 |
除杂试剂 |
除杂方法 |
| A |
CO(g) |
CO2(g) |
饱和NaHCO3溶液、浓硫酸 |
洗气 |
| B |
FeCl2(aq) |
CuCl2 |
铁粉 |
过滤 |
| C |
Cl2(g) |
HCl(g) |
NaOH溶液、浓硫酸 |
洗气 |
| D |
NaHCO3(aq) |
Na2CO3(aq) |
盐酸 |
— |
将下列待分离的物质与相应的分离方法用直线连接起来。
(1)从硝酸钾和氯化钠的混合液中获得硝酸钾 分液
(2)分离水和煤油的混合物 结晶
(3)提取碘水中的碘 萃取
下列除去杂质(括号中的物质为杂质)的方法中,不正确的是
| A.FeCl3溶液(FeCl2):通入适量Cl2 |
| B.Fe2O3固体(Al2O3):加入足量的盐酸,过滤 |
| C.CO气体(CO2):通过NaOH溶液洗气后干燥 |
| D.Cl2气体(HCl):通过饱和NaCl溶液洗气后干燥 |