(10分)硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业.某研究小组设计SnSO4制备路线如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡
回答下列问题:
(1)锡原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是 .
(2)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 .
(3)加入Sn粉的作用有两个:①调节溶液pH ② .
(4)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 .
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 .
除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法均正确的一组是
| 选项 |
待提纯的物质 |
选用的试剂 |
操作的方法 |
| A |
CaO(CaCO3) |
水 |
溶解、过滤、结晶 |
| B |
Cu(CuO) |
稀盐酸 |
溶解、过滤、洗涤、干燥 |
| C |
CuSO4(H2SO4) |
氢氧化钠溶液 |
过滤 |
| D |
CO(H2) |
氧气 |
点燃 |
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
(1)提高“反应l”反应速率的措施有______________(写出一条即可)。
(2)“反应2”的氧化剂是________,该反应的化学方程式为__________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从 “母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经_____________(填操作名称)即可获得粗产品。
化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是( )
| A.定性检验SO42—,将BaCl2溶液用HNO3酸化 |
| B.为了提高KMnO4溶液的氧化能力,用盐酸将其酸化 |
| C.配制FeCl3溶液时通常加少量HNO3酸化,减小其水解程度 |
| D.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液 |
下列实验不能达到实验目的的是
| A.用CaCl2溶液可区别Na2C03和NaHCO3溶液 |
| B.用CC14萃取碘水中的碘 |
| C.用饱和NaHCO3溶液除去C02中的HCI |
| D.检验未知溶液是否含S042-,可先加氯化钡,再加稀盐酸 |
(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12L b.>1.12L c.<1.12L
以下是25℃时几种难溶电解质的溶解度:
| 难溶电解质 |
Mg(OH) 2 |
Cu(OH) 2 |
Fe(OH) 2 |
Fe(OH) 3 |
| 溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子,例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为____________(填化学式)而除去.
(2)①中加入的试剂应该选择________为宜,其原因是_________________.
(3)②中除去Fe3+所发生的总反应的离子方程式为_____________________.
(4)下列与方案③相关的叙述中,正确的是________(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
某地煤矸石经预处理后含SiO2、Al2O3、Fe2O3,一种综合利用煤矸石制取绿矾(FeSO4·7H2O)的工艺流程如下图所示。
(1)过滤操作需要用到的玻璃仪器除了烧杯、玻璃棒还有_____________。
(2)写出所选试剂X、Y的化学式:X_______________,Y_____________。
(3)滤液B中含的阴离子有_____________(写离子符号)。
(4)滤渣SiO2可制取木材防火剂,该防火剂的化学式为______________。
(5)由溶液D转化为溶液E的离子方程式为:______________。
(6)根据图中数据,计算出原40g煤矸石中Fe2O3的质量分数为_____________。(假设适量均为恰好反应)
现有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3、Na2SO4现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀产生:
②向①的悬浊液中加入过量稀盐酸,白色沉淀部分溶解,并有气泡放出:
③取少量②的上层清液滴入硝酸银溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题:
(1)判断原白色粉末中肯定含有, ,可能含有 。
(2)写出上述实验中一定发生的有关反应的离子反应方程式: 。
Ⅰ.现有Al3+、NH4+、CO32—、HCO3— 等离子,回答下例问题:
①在强酸性条件下能够存在的离子是 ;
②在强碱性条件下能够存在的离子是 ;
③在强酸性和强碱性条件下都不能存在的离子是 。
Ⅱ.由Na+、NH4+、 Ba2+、 Cu2+、 OH—、 Fe3+、 SO42—、 Cl— 等八种离子中的六种两两组成的A、B、C三种化合物(它们不含有共同离子,已知NH4+与OH— 反应有碱性气体生成)。
A.A、B、C均易溶于水,形成无色溶液;
B.将A、B、C三种物质的溶液相互作用时,发现A与B混合后产生有刺激性气味的气体,此气体使湿润红色石蕊试纸变蓝,B与C混合产生白色沉淀,则:
①A、B、C的化学式为:
A、 ;
B、 ;
C、 。
②B+C反应的离子方程式为: 。
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。现有一红色粉末可能含有Fe2O3和Cu2O中的一种或两种,设计合理的实验探究样品中Fe2O3、Cu2O的存在。
查阅数据知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
请完成以下实验探究过程:
(一)提出假设
假设1:红色粉末是Fe2O3;
假设2:红色粉末是__________________;
假设3:红色粉末是___________________。
(二)设计实验方案
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是_________________________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?______________。简述你的理由________________________。
(3)若固体粉末完全溶解,向所得溶液中滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是_______________。写出实验过程中发生反应的离子方程式________________、_______________、__________________。
(4)若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为_______。
某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl﹣、CO32﹣、SO42﹣、NO3﹣中的若干种,现取适量溶液进行如下实验
下列有关判断正确的是
A.原溶液中一定有Fe2+、SO42﹣、H+、NH4+、Al3+
B.原溶液中一定没有Ba2+、CO32﹣、NO3﹣
C.步骤③中反应的离子方程式为2AlO2﹣+CO2+3H2O=2Al(OH)3↓+CO32﹣
D.气体A、B之间肯定不能发生反应
ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
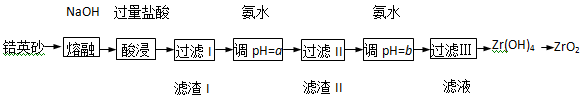
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
| 金属离子 |
Fe3+ |
Al3+ |
ZrO2+ |
| 开始沉淀时pH |
1.9 |
3.3 |
6.2 |
| 沉淀完全时pH |
3.2 |
5.2 |
8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为 ,滤渣I的化学式为 。
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是 ;继续加氨水至pH=b时,所发生反应的离子方程式为 。
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为 。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是 。
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式为___________。
(2)试用下图中所列各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):________→______→_______→_________。
(3)实验室可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是________,B瓶溶液的作用是__________,C瓶溶液的作用是___________。
(4)装置②中所加的固体药品是________,可确证的产物是_________,确定装置②在整套装置中位置的理由是__________。
(5)装置③中所盛溶液是__________,可验证的产物是____________。
2012年3月21 日是第二十届“世界水日”,保护水资源,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的________倍。
(2)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3—、CO32—、SO42—离子中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关现象如下图所示:

请根据上图回答下列问题:
①实验中需配制1.0 mol/L的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为_________________________________________。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为____________________。
③试确定NO3—是否存在?________(填“存在”、“不存在”或“不确定”),若存在,试计算c(NO3—)=________(若不存在,此问不必作答)。