下列说法正确的是
①具有规则几何外形的固体一定是晶体
②NaCl晶体中与每个Na+距离相等且最近的Na+共有12个
③非极性分子中一定含有非极性键
④晶格能由大到小: NaF> NaCl> NaBr>NaI
⑤含有共价键的晶体一定具有高的熔、沸点及硬度
⑥s-s σ键与s-p σ键的电子云形状相同
⑦含有π键的化合物与只含σ键的化合物的化学性质不同
⑧中心原子采取sp3杂化的分子,其立体构形不一定是正四面体
| A.①②⑤⑥ | B.③④⑥⑦ | C.②④⑦⑧ | D.③④⑤⑧ |
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的基态电子排布式为______________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图示。该合金的化学式为_______________;
(4)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。该结构中,氮原子的杂化轨道类型为_______________。氧原子的杂化轨道类型为_______________。
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
(1)某同学根据上述信息,推断B的核外电子排布如右图所示,该同学所画的电子排布图违背了 。
(2)ACl2分子中A的杂化类型为 。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,并阐述理由 。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式 ,该物质的K原子和C60分子的个数比为 。
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 ,NCl3分子的VSEPR模型为 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
【化学一选修3:物质结构与性质】(15分)
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、 (PAN)等二次污染物。
(PAN)等二次污染物。
①1mol PAN中含有的σ键数目为_______。PAN中除H外其余三种元素的第一电离能由大到小的顺序为_________________。
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为_______,中心离子的核外电子排布式为_______________。
③相同压强下,HCOOH的沸点比CH3OCH3____(填“高”或“低”),其原因是___________________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间的作用力不涉及___________(填序号)。
a.离子键
b.共价键
c.配位键
d.范德华力
e.氢键
②NH4NO3中阳离子的空间构型为_____,阴离子的中心原子轨道采用_______杂化。
(3)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=_____(填数字)。
汽车作为一种现代交通工具正在进入千家万户,汽车尾气的污染问题也成为当今社会急需解决的问题。为使汽车尾气达标排放,催化剂及载体的选择和改良是关键。目前我国研制的稀土催化剂催化转化汽车尾气示意图如图甲:
甲 乙
(1)下列有关说法正确的是________。
| A.C3H8中碳原子都采用的是sp3杂化 |
| B.O2、CO2、N2都是非极性分子 |
| C.每个N2中,含有2个π键 |
| D.CO的一种等电子体为NO+,它的电子式为[:N⋮⋮O:]+ |
(2)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍为0价,镍原子在基态时,核外电子排布式为_____________________;[Ni(CO)4]的配体是________,配位原子是________。
(3)Zr原子序数为40,价电子排布式为4d25s2,它在周期表中的位置是________。
(4)为了节省贵重金属并降低成本,也常用钙钛矿型复合氧化物催化剂。一种复合氧化物晶体结构如图乙,则与每个Sr2+紧邻的O2-有________个。
A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大。A原子的核外成对电子数与未成对电子数相等,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素。D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满;E原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
⑴A、B、C的第一电离能由小到大的顺序为 。
⑵D与E的原子化热分别为340 kJ·mol-1和125 kJ·mol-1,则它们的熔点:D E(填“>”、“<”、“="”" )。
⑶分子A2B2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为_____________,1mol该分子中含有 键的数目为 。
键的数目为 。
⑷基态E原子的外围电子排布式为 。EO2Cl2熔点:-96 .5℃,沸点:117℃,则固态EO2Cl2属于 晶体。
⑸D的氢化物的晶体结构如右图所示,其化学式是 ,图中白球构成的晶体结构是由 (填“密置层”或“非置密层”)按一定的方式在三维空间堆积形成的,写出此氢化物在氯气中燃烧的化学方程式 。
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、O四种元素的电负性由小到大的顺序为 。
②下列叙述不正确的是 。(填字母)
A.因为HCHO为极性分子,水也为极性分子,根据相似相溶原理,HCHO易溶于水。
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个 键和1个大
键和1个大 键,C2H2是非极性分子
键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 。
②六氰合亚铁离子[Fe(CN)6]4 -中不存在 。
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
写出一种与 CN- 互为等电子体的单质分子式 。
(3)根据元素原子的外围电子排布特征,可将周期表分成五个区域,其中Ti属于 区。
(4)一种Al-Fe合金的立体晶胞如下图所示。请据此回答下列问题:
①确定该合金的化学式 。
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
2CuCl+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):
请回答下列问题:
(1)配离子[Cu(En)2]2+的中心原子基态外围电子排布式为 ,
H、N、O三种元素的电负性由大到小的顺序是 ;
(2)SO2分子的空间构型为 ;
(3)乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
(4)配离子[Cu(En)2]2+的配位数为 ,该微粒含有的微粒间的作用力类型有 (填字母);
| A.配位键 | B.极性键 | C.离子键 | D.非极性键 |
E.氢键 F.金属键
(5)CuCl的晶胞结构如右图所示,其中Cl-的配位数(即与Cl-最近距离的Cu+的个数)为 。
(1)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体易溶于水,则此种化合物是 (填“极性”、“非极性”)分子。
(2)今有A、B、C、D四种元素,它们的原子序数依次增大,且均小于18,A和B在同一周期,A原子p能级有一个空轨道,B原子的p能级有两个未成对电子,0.1mol C单质能从酸中置换出 2.24L氢气(标准状态),此时它就变成与B离子电子层排布完全相同的离子。D离子的半径在B、C、D中为最小。则:
①A是_________,B是_________,C是_________,D是__________。(填名称)
②A单质和B单质充分反应生成的化合物的电子式是____________。
③我国科学工作者于20世纪90年代在兰州制备出过去一直依赖进口,价格十分昂贵的B的一种同位素形成的单质,1mol这种单质中含中子的物质的量是20mol,则这种同位素原子的符号为________。
(3)把CoCl2溶于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使生成[Co(NH3)6]2+,此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示,Co的配位数是6。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1molCoCl3·5NH3只生成2molAgCl。CoCl3·5NH3中Co化合价为 ,请写出表示此配合物结构的化学式: 。
(4)核内中子数为N的R2+,质量数为A,则ng它的氧化物中所含质子的物质的量是
。
原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为24。
(1)F原子基态的核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由大到小的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。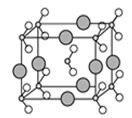
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去,也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3∶1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)B与D形成的非极性分子中中心原子的孤电子对数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是________(写分子式),它们的稳定性由弱到强的顺序是________(写分子式)。
(3)分子ABC、BA2D的空间构型分别是________、________。
(4)B、C、D三种元素的电负性由大到小的顺序是________(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)一个C的单质分子中存在________个π键、________个σ键。
(6)E的三种同素异形体,晶胞如图所示:
其中晶胞γ的堆积模型中E原子的配位数为________,该晶胞中所含原子数为________。
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;B在第三周期且化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,位于第四周期第IB族,请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为 。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点 (填高或低),理由是 。
(3)E的最高价氧化物分子的空间构型是 。
(4)F的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 .
(5)A、F形成某种化合物的晶胞结构如图所示,则其化学式为 ;(黑色球表示F原子)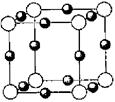
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型为 。
A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表。Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子。
| |
A |
B |
D |
E |
| 化合价 |
-4 |
-2 |
-3 |
-2 |
| 电负性 |
2.5 |
2.5 |
3.0 |
3.5 |
(1)基态Fe原子的电子排布式为 。
(2)Fe、Co两元素的第三电离能I3(Fe) I3(Co)(填“<”或“>”)。
(3)B、D、E的气态氢化物的沸点由高到低的顺序为 (填化学式)。
(4)Co与E形成的化合物晶胞如右图所示,则该化合物的化学式为 。(用元素符号表示)
(5)Co的离子能与AD-离子生成各种配合物。紫色的配离子[Co(AD)6]4-是一种相当强的还原剂,在加热时能与水反应生成[Co(AD)6]3-。
①HAD分子中A元素的杂化类型为 ,D元素的化合价为 。
②写出[Co(AD)6]4-在加热时与水反应生成[Co(AD)6]3-的离子方程式: 。
短周期非金属元素A、B、C的核电荷数依次增大,A原子的外围电子排布式为ns2np2,C是地壳中含量最多的元素。元素D、E都位于第四周期,其中E的核电荷数为29,D原子的核外未成对电子数在同周期中是最多的。请用对应的元素符号或化学式填空:
(1)元素A、B、C的第一电离能由小到大的顺序为________。
(2)已知(AB)2分子中键与键之间的夹角为180°,并有对称性,且每个原子的最外层电子数均满足8电子结构,则其结构式为________,1 mol该分子中含有的π键的数目为________。
(3)基态D原子的外围电子排布式为________。化合物DO2Cl2的熔点是-96.5 ℃,沸点是117 ℃,则固态DO2Cl2属于________晶体。
(4)已知元素E的氢化物的晶胞结构如上图所示,则其化学式为___________
铜、碳、氮、硫、氯等是组成物质的重要元素。
(1)S、Cl组成的一种化合物的分子结构与H2O2相似,则此化合物的结构式为________。N、O、S三种元素的电负性由大到小的顺序为____________。
(2)铜离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。某化合物Y与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图甲所示的离子。
①写出Cu(Ⅰ)的电子排布式:____________;
②该离子中含有化学键的类型有________(填序号);
| A.极性键 | B.离子键 | C.非极性键 | D.配位键 |
③该离子中C原子的杂化方式有________。
(3)向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的结构如图乙所示。写出该反应的离子方程式:_____________________________________
___________________________________。