已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;B在第三周期且化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,位于第四周期第IB族,请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为 。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点 (填高或低),理由是 。
(3)E的最高价氧化物分子的空间构型是 。
(4)F的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 .
(5)A、F形成某种化合物的晶胞结构如图所示,则其化学式为 ;(黑色球表示F原子)
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型为 。


 ,如f(1)=1+
,如f(1)=1+ ,f(2)=1+
,f(2)=1+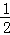 ,则f(1)•f(2)•f(3)…f(10)= .
,则f(1)•f(2)•f(3)…f(10)= .
 粤公网安备 44130202000953号
粤公网安备 44130202000953号