喷泉实验装置如图所示。应用下列各组气体﹣﹣溶液,能出现喷泉现象的是( )
|
气体 |
溶液 |
|
|
A. |
H2S |
稀盐酸 |
|
B. |
HCl |
稀氨水 |
|
C. |
NO |
稀H2SO4 |
|
D. |
CO2 |
饱和NaHCO3溶液 |

A.AB.BC.CD.D
过渡金属元素及其化合物的应用广泛,是科学家们进行前沿研究的方向之一。
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉做显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:
4FeCl3+2NH2OH•HCl=4FeCl2+N2O↑+6HCl+H2O
①基态Fe原子中,电子占有的最高能层符号为__________,核外未成对电子数为__________,Fe3+在基态时,外围电子排布图为______________________________。
②羟胺中(NH2OH)采用sp3杂化的原子有_______________,三种元素电负性由大到小的顺序为________;与ClO4-互为等电子体的分子的化学式为_______________________。
(2) 过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合18电子规则。如Cr可以与CO形成Cr(CO)6分子:价电子总数(18)=Cr的价电子数(6)+CO提供电子数(2×6)。Fe、Ni两种原子都能与CO形成配合物,其化学式分别为_____________、______________。
(3) Pt2+的常见配合物Pt(NH3)2Cl2存在两种不同的结构:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度较小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
①Q是_________________分子(选填“极性”或“非极性”)。
②P分子的结构简式为__________________________。
(4)NiXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为a pm。晶胞中两个Ni原子之间的最短距离为___________pm。若晶体中的Ni分别为Ni2+、Ni3+,此晶体中Ni2﹢与Ni3﹢的最简整数比为_________。
有A、D、E、G、M、L六种前四周期的元素。A是宇宙中最丰富的元素。D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态。G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8。L位于周期表第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如图所示。请回答下列问题:
(1)E元素的电负性________M元素的电负性(填“>”、“<”或“=”)。
(2)G的第一电离能比它同周期前一族相邻元素的第一电离能________(填“大”或“小”)。
(3)E-的最外层共有______种不同运动状态的电子,最外层电子分属______个能级。M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是__________,M2E2是_________分子(填“极性”或“非极性”)。
(4)M和G形成的一种化合物分子式为MG2,该分子的VSEPR模型为__________,分子的空间构形为___________。
(5)L的价电子排布式为_________,该元素位于周期表中_____族。
(6)R的化学式为________(用元素符号表示),属于_______晶体。已知R晶体的密度为ρ g•cm-3,则该晶胞的边长a="_____________" cm,(阿伏加德罗常数用NA表示)。
【化学—选修3:物质结构与性质】
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac+ CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式 。
②氨水溶液中各元素原子的第一电离能从大到小排列顺序为 ,理由是 ;其中NH3应为 (填“极性”或“非极性”)分子。
③醋酸分子中的两个碳原子的化方式分别是 。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有 。(填序号)
a.离子键 b.金属键 c. 共价键 d. 配位键
(2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞 。(填“侧面”或“内部”)
②根据以上信息可以推知,XY2晶体的熔沸点 (填“>”“=”“<”)固态氨的沸点。
③若该晶胞的边长为a nm,密度为 ,XY2的摩尔质量为
,XY2的摩尔质量为 ,则阿伏加德罗常数可表示为
,则阿伏加德罗常数可表示为
1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。
 (1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 |
NaCl |
KCl |
CaO |
| 晶格能/(kJ·mol-1) |
786 |
715 |
3401 |
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 ,Na、Mg、Al第一电离能I1从小到大的排列顺序是 。 (2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。

①实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,其原因是 。 ②SO42-中S原子的杂化类型是 ,与其互为等电子体的分子有 (任写一种)
②SO42-中S原子的杂化类型是 ,与其互为等电子体的分子有 (任写一种) ③Cu2+还能与NH3、Cl-等形成配位数为4的配合物,[Cu(NH3)4]2+中存在的化学键类型有 (填序号)。
③Cu2+还能与NH3、Cl-等形成配位数为4的配合物,[Cu(NH3)4]2+中存在的化学键类型有 (填序号)。
A.配位键 B.离子键 C.极性共价键D.非极性共价键 ④写出基态Cu原子的外围电子排布式 ;
④写出基态Cu原子的外围电子排布式 ;
金属铜采用面心立方堆积方式,已知Cu原子的半径为r pm,相对原子质量为M,NA表示阿伏加德罗常数,则金属铜的密度是 g/cm3(列出计算式)。
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是 。(填字母)
A.HCHO与水分子间能形成氢键
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.苯分子中含有6个 键和1个大
键和1个大 键,苯是非极性分子
键,苯是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元素 |
Mn |
Fe |
|
| 电离能 /kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
Mn元素价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(3)铁原子核外有__________种运动状态不同的电子。
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。
(5)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为 。
(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为 。
②与CNO-互为等电子体微粒的化学式为 (写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 |
NaCl |
KCl |
CaO |
| 晶格能/(kJ•mol-1) |
786 |
715 |
3401 |
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是__________,Na、Mg、Al第一电离能I1从小到大的排列顺序是____________。
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均采用虚线表示。
①实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,其原因是_________________。
②SO42-中S原子的杂化类型是,与其互为等电子体的分子有________(任写一种)。
③Cu2+还能与NH3、Cl-等形成配位数为4的配合物,[Cu(NH3)4]2+中存在的化学键类型有__(填序号)。
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
④写出基态Cu原子的外围电子排布式;金属铜采用面心立方堆积方式,已知Cu原子的半径为r pm,相对原子质量为M,NA表示阿伏加德罗常数,则金属铜的密度是_____g/cm3(列出计算式)。
第VA族元素及其化合物在生产、生活中有着广泛的应用
(1)砷的电子排布式为 ,N、P、As三种元素的最常见氢化物沸点由高到低的顺序为 ,高纯度砷可用于生产半导体材料GaAs,在GaAs晶体中,Ga、As原子最外电子层均达到8电子稳定结构,则GaAs晶体中砷的配位数为 。
(2)对硝基苯酚水合物是一种具有特殊功能的物质,其结构简式为 。该物质中几种元素的第一电离能由大到小的顺序是 ,该物质的晶体中肯定不存在的作用力是 。
。该物质中几种元素的第一电离能由大到小的顺序是 ,该物质的晶体中肯定不存在的作用力是 。
a.氢键 b.极性键 c.范德华力 d.离子键 e.σ键
(3)科学家将NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,则该阴离子的化学式是 。
(4)PM2. 5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、O3、CH2=CHCHO、HCOOH、CH3COOONO2 (PAN)等二次污染物。
①N2O结构式可表示为N=N=O,N2O中氮原子的杂化轨道类型为 ,1 mol PAN中含σ键数目为 。
②测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85 Kr。Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则 = (填数字)。已知Kr晶体的密度为ρg/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a = nm。
= (填数字)。已知Kr晶体的密度为ρg/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a = nm。
A、B、C、D、E、F、G为前四周期元素。A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素,基态G原子核外电子填充在7个能级中,且价层电子均为单电子。
(1)元素B、C、D的第一电离能由大到小的顺序为______________(用元素符号表示)。
(2)ED3分子的空间构型为________,中心原子的杂化方式为_________。
(3)四种分子①BA4②ED3③A2D④CA3键角由大到小排列的顺序是__________(填序号)。
(4)CA3分子可以与A+离子结合成CA4+离子,这个过程中发生改变的是_________(填序号)。
a.微粒的空间构型 b.C原子的杂化类型
c.A-C-A的键角d.微粒的电子数
(5) EBC-的等电子体中属于分子的有__________(填化学式),EBC-的电子式为______________。
(6)G的价层电子排布式为________,化合物[G(CA3)6]F3的中心离子的配位数为 。
(7)B的某种单质的片层与层状结构如图1所示,其中层间距离为hcm.图2为从层状结构中取出的晶胞。试回答:
①在B的该种单质的片层结构中,B原子数、B-B键数、六元环数之比为 。
②若B的该种单质中B-B键长为a cm,则B的该种单质的密度为 g.cm-3。
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布布式为 。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe基态核外电子排布式为 。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的第一电离能由大到小的顺序为 。
(3)与OCN-互为等电子体的一种分子为 (填化学式)
(4)铁元素还能与一些氨基酸形成配合物,羧基中碳原子的杂化类型是 ;1mol乙酸中含有σ键的数目为 。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为 。
A、B、C、D、E、F、G为前四周期元素。A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子。
(1)元素B、C、D的第一电离能由大到小的顺序为 (用元素符号表示)。
(2) ED3分子的空间构型为________,中心原子的杂化方式为________________________。
(3)四种分子①BA4②ED3③A2D④CA3键角由大到小排列的顺序是 (填序号)。
(4) CA3分子可以与A+离子结合成CA4+离子,这个过程中发生改变的是________(填序号)。
a.微粒的空间构型 b.C原子的杂化类型
c.A-C-A的键角 d.微粒的电子数
(5) EBC-的等电子体中属于分子的有 (填化学式),EBC-的电子式为 。
(6)G的价层电子排布式为________,化合物[G(CA3)6]F3的中心离子的配位数为 。
(7)B的某种单质的片层与层状结构如图1所示,其中层间距离为hcm.图2为从层状结构中取出的晶胞。试回答:
①在B的该种单质的片层结构中,B原子数、B-B键数、六元环数之比为 。
②若B的该种单质中B-B键长为a cm,则B的该种单质的密度为 g.cm-3。
有关元素的部分信息如下表所示:
| 元素 |
A |
B |
R |
D |
| 相应信息 |
短周期元素、最高正价为+7 |
基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子 |
R核外电子共有15种运动状态 |
D与A能形成两种常见的化合物DA2,DA3 |
回答下列问题:
(1)D的基态原子电子排布式为 ,A、B、D三种元素电负性由大到小的顺序为 (用具体的元素符号填写)。
(2)化合物BA4、RA3、RA5中,中心原子的轨道类型不是sp3杂化的是 ,分子构型是正四面体的是 ,属于极性分子的是 (用化学式填写)。
(3)已知DA3的沸点:319℃,熔点:306℃,则DA3的晶体类型为 ,B与氢元素能形成BnH2n+2(n为正整数)的一系列物质,这一系列物质沸点的变化规律是 。
(4)R可形成H3RO4、HRO3、H3RO3等多种酸,则这三种酸酸性由强到弱的顺序为 (用化学式填写)。
(5)已知D的单质有如图所示的两种常见堆积方式:其中属于面心立方最密堆积的是 (填a或b);若单质D按b方式紧密堆积,原子半径为r cm,NA表示阿伏加德罗常数的值,则单质D的密度 g/cm3(列出算式即可)。
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。回答下列问题:
(1)基态铜原子的电子排布式为 ;已知高温下CuO—→Cu2O+O2,试从铜原子价层电子结构变化角度解释这一反应发生的原因:________________________。
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ,若“Si-H”中键合电子偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为________________。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3.NH3,BF3.NH3中B原子的杂化轨道类型为____,B与N之间形成 键。
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为 ,在SiC中,每个C原子周围最近的C原子数目为 ,若晶胞的边长为a pm,则金刚砂的密度为 。
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
(1)F的基态原子电子排布式为 。
(2)B、C、D的原子的第一电离能由小到大的顺序为 (用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是 。
a.分子中都含有σ键和π键
b.B2A2分子的沸点明显低于A2D2分子
c.都是含极性键和非极性键的非极性分子
d.互为等电子体,分子的空间构型都为直线形
e.中心原子都是sp杂化
(4)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中。与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 。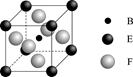
(5)向GSO4(aq)中逐滴加入过量氨水,会发生先产生蓝色沉淀后沉淀消失,写出沉淀消失的离子反应方程式: 。