A、B、C、D、E、F、G为前四周期元素。A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素,基态G原子核外电子填充在7个能级中,且价层电子均为单电子。
(1)元素B、C、D的第一电离能由大到小的顺序为______________(用元素符号表示)。
(2)ED3分子的空间构型为________,中心原子的杂化方式为_________。
(3)四种分子①BA4②ED3③A2D④CA3键角由大到小排列的顺序是__________(填序号)。
(4)CA3分子可以与A+离子结合成CA4+离子,这个过程中发生改变的是_________(填序号)。
a.微粒的空间构型 b.C原子的杂化类型
c.A-C-A的键角 d.微粒的电子数
(5) EBC-的等电子体中属于分子的有__________(填化学式),EBC-的电子式为______________。
(6)G的价层电子排布式为________,化合物[G(CA3)6]F3的中心离子的配位数为 。
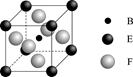
(7)B的某种单质的片层与层状结构如图1所示,其中层间距离为hcm.图2为从层状结构中取出的晶胞。试回答:

①在B的该种单质的片层结构中,B原子数、B-B键数、六元环数之比为 。
②若B的该种单质中B-B键长为a cm,则B的该种单质的密度为 g.cm-3。
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
(1)F的基态原子电子排布式为 。
(2)B、C、D的原子的第一电离能由小到大的顺序为 (用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是 。
a.分子中都含有σ键和π键
b.B2A2分子的沸点明显低于A2D2分子
c.都是含极性键和非极性键的非极性分子
d.互为等电子体,分子的空间构型都为直线形
e.中心原子都是sp杂化
(4)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中。与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 。
(5)向GSO4(aq)中逐滴加入过量氨水,会发生先产生蓝色沉淀后沉淀消失,写出沉淀消失的离子反应方程式: 。
H、C、N、O、都属于自然界中常见非金属元素。
(1)O、C、N三种元素的第一电离能由小到大顺序是 ;NH4+中氮原子轨道的杂化类型为________。 (2)CO、N2的结构可表示为:
(2)CO、N2的结构可表示为:
两者的键能数据:(单位kJ/mol)
| |
A—B |
A=B |
 |
| CO |
357.7 |
798.9 |
1071.9 |
| N2 |
154.8 |
418.4 |
941.7 |
结合数据说明CO比N2活泼的原因 。
(3)乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
(4)C、N元素形成的新材料具有如图所示结构,该晶体硬度将超过目前世界上最硬的金刚石,成为首屈一指的超硬新材料。 该物质的化学式为: 。
X、Y、Z、Q、W为按原子序数由小到大排列的五种短周期元素,已知:
①x元素与Q处于同一主族,其原子价电子排布式都为ns2np2,且x原子半径小于Q的原子半径;
②Y元素是地壳中含量最多的元素;w元素的电负性略小于Y元素;在w原子的电子排布中,P轨道上只有1个未成对电子;
③Z元素的电离能数据见下表(kJ·mol-1)
| I1 |
I2 |
I3 |
I4 |
… |
| 496 |
4562 |
6912 |
9540 |
… |
(1)XY2分子空间构型为____________________________。QX的晶体结构与金刚石的相似,其中X原子的杂化方式为_______________,微粒间存在的作用力是____________。
(2)晶体ZW的熔点比晶体XW4明显高的原因是______________。
(3)氧化物MO的电子总数与QX的相等,则M为_____(填元素符号)。MO是优良的耐高温材料,其晶体结构与ZW晶体相似。MO的熔点比CaO的高,其原因是___________________________________。
A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大。第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的最高价含氧酸根离子中其中心原子采取 杂化。
(3)与A、B形成的阴离子(AB-)互为等电子体的分子有 。
(4)基态D原子的核外电子排布式为 ,下图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比为 。
(5)向D的高价态硫酸盐溶液中逐滴滴加B的氢化物水溶液至过量,先出现沉淀,最后沉淀溶解形成溶液。写出此沉淀溶解的离子方程式:_ ___。
已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子。R+核外有28个电子。请回答下列问题:(答题时,A、D、E、G、L、M、R用所对应的元素符号表示)
(1)E、G、M的第一电离能由大到小的顺序为 。
(2)下图是由Q、R、G三种元素组成的一种高温超导体的晶胞结构,其中R为+2价,G为-2价。基态R2+的核外电子排布式为 ;Q的化合价为 价。
(3)1 mol晶体L中含有δ键的数目为 。
(4)G与M可形成MG3与MG2,MG3分子的空间构型是 ,MG2中M原子的杂化方式是 。
(5)在(EA4)2R(MG4)2中存在的化学键除极性键外,还有 (填字母)。
a.离子键 b. 氢键 c.配位键 d.金属键
A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D、E是第四周期元素,其中E元素的核电荷数为29。D原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为 ,1mol该分子中含有 键的数目为 。
键的数目为 。
(3)基态D原子的外围电子排布式为 。DO2Cl2熔点:-96 .5℃,沸点:117℃,则固态DO2Cl2属于 晶体。
(4)E的氢化物的晶胞结构如图所示,其化学式是 。 
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大。W原子核外有2个未成对电子,Q是电负性最大的元素,R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍。请回答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
(l)W、Y、Z 三种元素的第一电离能由大到小的顺序为 。在上述三种元素的原子中,写出与WZ2互为等电子体的分子式 。
(2)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键)
该分子中Y原子的杂化方式是 杂化。
(3)W2-2阴离子的电子式为 ,Z原子最外层电子排布式为 。
(4)YQ3分子的空间构型为 ,Y和Q两元素的氢化物的沸点相比较,高者是 (写分子式).往硫酸铜溶液中通入过量的YH3(Y的氢化物分子式),可生成配离子[Cu(YH3)4]2+,但YQ3不易与Cu2+形成配离子,其原因是 。
(5)科学家通过X射线探明RZ的晶体结构与NaCl晶体结构相似。那么在RZ晶体中距离R2+最近且等距离的R2+有 个。若在RZ晶体中阴阳离子间最近距离为a cm,晶体密度为ρg/cm3,则阿伏伽德罗常数NA的表达式为 mol-1。
(6)已知非整数比化合物R0.95Z,其晶体结构与NaCI相似,但由于R、Z离子个数比小于1:1,故晶体存在缺陷。R0.95Z可表示为( )
A-E是周期表中1一36号的元素,它们的原子序数依次递增且分别位于前四周期的各个周期中。对它们的性质及结构的描述如下。
A原子的基态只有一种形状的电子云,并容易形成共价键;B原子的最外电子层的电子排布可表示为nsnnpn,其元素最高正化合价与最低负化合价的代数和为0;C与B同周期,其第一电离能髙于周期表中与之相邻的所有元素;D元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大;E原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第IA族元素。
(1)请写出E原子基态的电子排布式____________。
(2)A与C形成的最简单化合物(甲)分子的立体结构是____________,其中C原子的杂化方式是______
(3)A与D元素形成的化合物(乙)与甲相比,沸点较低的是(写化学式)____________原因是________________________
(4)B元素可形成B70单质,它在一定条件下吸收可见光后可高效杀灭癌细胞,有望成为癌症治疗药物的候选材料。它与金属钾掺杂在一起的化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),则该化合物中B70与钾原子个数比为______。
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D原子核外哑铃形原子轨道上有2个未成对电子,D与A形成的化合物分子构型是V型。B元素是形成化合物种类最多的元素,A、B的最外层电子数之和与C的最外层电子数相等,F是同周期第一电离能最小的元素。
(1)写出C元素基态原子的价电子排布式 ;B、C、D三种元素电负性由大到小的顺序为(用元素符号表示) ;
(2)E与A能形成分子式为EA的化合物。接近EA沸点的EA蒸气的相对分子质量测量值要大于其分子计算值,原因是 ;C、D分别与A形成最简单分子中,稳定性较高的是 (填化学式)分子;该分子再与A+结合成离子时,ACA键的键角会 (填“变大”、“不变”或“变小”)
(3)C与F形成的化合物FC3中,C3的空间构型为 ,C3—中心原子采用 杂化。灼烧FC3时,火焰呈现特殊颜色,请从原理上解释产生该现象的原因: 。
(4)右图为B元素的某种单质晶体的晶胞,则该晶体中B原子的空间占有率为 (用r表示B的原子半径,用带r的表达式表示,不必简化)
A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金。
(1)E2+的核外电子排布式为 。
(2)CB32-的立体构型是(用文字描述) ;其中心原子的杂化轨道类型为 。
(3)根据等电子原理,AB分子的电子式为 ;其中σ键与π键之比为 。
(4)[E(H2O)6]3+内E3+与H2O间的作用力为 。
(5)D2C的晶胞结构与CaF2晶胞(如图)相似,则Y应为 (填离子符号);D2C的熔点比CaF2熔点 (填“高”、“低”或“无法比较”)。
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。试回答下列有关的问题:
(1)写出F元素的电子排布式_______。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为______。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是______。
(4)B、C、D、E的第一电离能由大到小的顺序是______ (写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
晶胞中距离一个Na+最近的Na+有____________个。若晶体密度为ρ g·cm-3,阿伏加德罗常的值用NA表示,则Cl-的离子半径_____cm(用含NA与ρ式子表达)。
有A、B、C、D四种元素。已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区。C元素原子的外围电子层排布式为nsn—1npn—1。 D原子M能层为全充满状态,且最外层电子只有一个。请回答下列问题:
(1)ACl3分子中A的杂化类型为 。ACl3分子的空间构型为 。
(2)某同学根据上述信息,推断B的核外电子排布如右图所示,
该同学所画的电子排布图违背了 。
(3)A、B、C三元素原子第一电离能由大到小的顺序为 (用元素符号表示)。C60分子中每个原子只跟相邻的3个原子形成共价键,且每个原子最外层都满足8电子稳定结构,则C60分子中π键的数目为 。
(4)D的基态原子有 种能量不同的电子;D2+ 的价电子排布式为 。已知D晶体中微粒的堆积方式为面心立方堆积,晶体中一个晶胞的边长为a cm,则D晶体的密度为 (写出含a的表达式,用NA表示阿伏加德罗常数的值)。