已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A是原子半径最小的元素;B的基态原子中电子占有三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂。
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为______,E的基态原子的外围电子排布式为_______。
(2)A、B、C、D四种元素中电负性大小顺序的是__________________。
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程为_______________。
(4)下列叙述正确的是______(填序号)。
a.M是极性分子,N是非极性分子
b.M和BD2分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和1个π键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
②已知:Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol;
2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECl4(l)和BD气体的热化学方程式:_________。
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g)+3A2(g)==2CA3(g)ΔH<0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。
①试比较K1,K2的大小,K1________K2(填写“>”、“=”或“<”)。
②在40 0 0C时,当测得CA3 和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的v(C2)正____v(C2)逆(填写“>”、“= ”或“ < ”)。
(1)Fe3+可以与SCN-、CN-、F-、有机分子等形成很多的配合物。
①写出基态Fe3+的核外电子排布式 。
②已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为 。
③下图是SCN-与Fe3+形成的一种配合物,画出该配合物中的配位键(以箭头表示)。
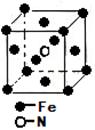
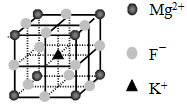
④F-不仅可与Fe3+形成[FeF6]3+,还可以与Mg2+、K+形成一种立方晶系的离子晶体(如下图)。该晶体的化学式为 。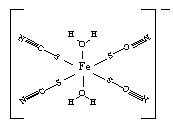
(2)氨气是一种重要的化工原料。
①液氨和水类似,也能发生电离:NH3+NH3 NH4++NH2-,其离子积常数为l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应生成NaNH2,假设溶液的体积不变,所得溶液中NH4+的浓度
NH4++NH2-,其离子积常数为l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应生成NaNH2,假设溶液的体积不变,所得溶液中NH4+的浓度
为 。
②已知:N2(g)+O2(g)=2NO(g) △H=+180kJ·mol-l
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-908 kJ·mol-l
写出氨气被一氧化氮氧化生成氮气和气态水的热化学方程式: 。
(3)在下图装置中,若通电一段时间后乙装置左侧电极质量增加。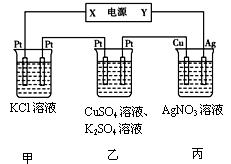
①下列说法错误的是 ;
| A.乙中左侧电极反应式:Cu2++2e-=Cu |
| B.电解一段时间后,装置丙的pH减小 |
| C.向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 |
| D.电解一段时间后,向乙中加入0.1molCu(OH)2可使电解质溶液复原,则电路中通过的电子为0.2mol②若将甲中溶液换成MgCl2,则电解总反应的离子方程式为; |
③若Cu电极上质量增加2.16 g, 甲溶液体积为200mL, 则甲溶液的pH= 。
X、Y、T、Q 四种元素,位于元素周期表前四周期,元素的性质或结构信息见下表。
| 元素 |
性质或结构信息 |
| X |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 |
| Y |
二价阳离子的外围电子层排布为3d9 |
| T |
原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂。 |
| Q |
第三周期主族元素中原子半径最小。 |
请根据上述信息回答下列问题:
(1)写出 X3- 的一种等电子体的化学式 ;X的气态氢化物易液化的原因: 。
(2)写出T元素基态原子的核外电子排布图 ;Q元素的原子核外有 种运动状态不同的电子。
(3)元素 X 、T 的电负性相比, 的小(填元素名称);元素 X 的第一电离能与T相比较,T的 (填“大”或“小”)。
(4)甲醛(CH2O)分子中σ 键与π 键的个数之比为 。
(5)Y元素在周期表中位于 区。Y单质晶体的晶胞如图所示,该晶胞中实际拥有 个原子,该晶体中Y原子在三维空间里的堆积方式为 堆积。
(6)在Y的硫酸盐溶液中通入X的气态氢化物至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。此蓝色沉淀溶解的离子方程式为: 。
(7)元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为: ,分子中X原子的杂化方式为 杂化。
已知A、B、C、D、M、W六种元素的原子序数依次递增,都位于前四周期。其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且S轨道电子数是P轨道电子数的两倍;C原子L层上有2对成对电子。M和W均有“生物金属”之称,M4+离子和氩原子的核外电子排布相同;W处于周期表中第8列。请回答下列问题:
(1)l mol B2A2分子中含σ键的数目是 。
(2)BC 2在高温高压下所形成的晶体其晶胞(晶体中最基本的重复单元)如图所示。则该晶体的类型属于 晶体(选填“分子”、“原子”、“离子”或“金属”);该晶体中B原子轨道的杂化类型为 。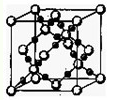
(3)“生物金属”M内部原子的堆积方式与铜相同,都是面心立方堆积方式,如图。若该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,M原子的摩尔质量为Mr g/mol,则该晶胞的“边长”为 cm。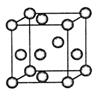
(4)“生物金属”W元素应用广泛,如人体内W元素的含量偏低,则会影响O2在体内的正常运输。已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图所示。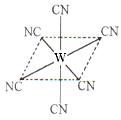
①W元素基态原子价电子排布式为 。
②CN—与 (一种单质分子)互为等电子体。
(5)光谱证实单质D与强碱溶液反应有[D(OH)4]—生成,则[D(OH)4]—中存在 。
a.极性键 b.配位键 c.σ键 d.π键
【化学、选修3--物质结构和性质】
I.如图为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。
①C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2,
请回答:
C20分子共有________个正五边形,共有________条棱边。
II.A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D元素的核电荷数为29。
请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为_______,1 mol该分子中含有π键的数目为______。该分子中碳原子的杂化轨道类型是_______,该分子属于________分子(填“极性”或“非极性”)。
(3)基态D原子的电子排布式为________________。
金属镍,铁及非金属元素碳在合金材料,有机合成材料中有广泛的应用.请回答下列问题:
(1)Ni原子的核外电子排布式为 .
(2)Fe原子的外围电子排布图为 .
(3)含碳化合物丙烯腈(H2C=CH—C≡N)分子中碳原子轨道杂化类型为
(4)NiO,FeO的晶体类型均与氯化钠晶体相同,Ni2+和Fe2+离子半径分别为69 Pm和78 Pm,则两种物质的熔点
NiO FeO(填“>”或“<”),判断依据是 .
(5)CaC2晶体的晶胞也与氯化钠相似,但由于CaC2晶体中的C22-存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C22-周围距离最近且相等的Ca2+数目为 ,C22-与O22+互为等电子体,写出O22+的电子式 .
(6)铁在一定条件下可形成体心立方堆积的晶体,设铁原子半径为r,请用含r的代数式表示该晶体空间利用率 .
已知A、B、C、D、E、F、G七种元素原子序数均小于36,它们的核电荷数依次增大。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的基态电子排布中L能层有两个未成对电子,E和D同主族;F原子的基态电子排布中有4个未成对电子;G与F在周期表中同族,且G原子的外围电子排布中有2个未成对电子。根据以上信息填空:
(1) B、C、D三种元素的电负性由大到小的顺序为 (用元素符号表示)
(2)F2+离子的价层电子排布图是 ,
(3)B元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,E元素的氢化物的VSEPR模型为 。
(4)A和C形成的二元共价化合物中,分子中既含有极性共价键、又含有非极性共价键的化合物_____(填化学式);其中心原子C的杂化方式为 。
(5)化合物BD2、C2D和阴离子EBC-互为等电子体,它们结构相似,EBC-的电子式为 。F常作为配合物的中心离子,1mol F(BC)63-中含有σ键的数目为_______;
(6)GD的晶体结构与氯化钠相同,在晶胞中G离子的配位数是_______;已知晶胞的边长为a nm,晶体的摩尔质量为b g·mol-1,NA为阿伏加德罗常数的值,则晶体的密度为_________g·cm-3。
(1)CH3+ 、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是
| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们互为等电子体,碳原子均采取sp2杂化 |
| C.CH3-与NH3、H2O+互为等电子体,几何构型均为三角锥形 |
| D.CH3+中的碳原子采取sp2杂化,所有原子均共面 |
E.两个-CH3(甲基)或一个CH3+和一个CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①锌在元素周期表中的位置是:_ 。
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式 ,葡萄糖分子[CH2OH(CHOH)4CHO]中碳原子杂化方式有 。
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于 (填“极性分子”或“非极性分子”);在〔Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键。
④右上图示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的Zn与X的原子个数之比为 。
⑤在④的晶胞(右上图)中,如果只考查X的排列方式,则X的堆积方式属于金属晶体堆积方式中的___ 堆积;设该晶胞中Zn的半径为r1 cm,其相对原子质量为M1,X的半径为r2cm,其相对原子质量为M2,则该晶体的密度为_ g/cm3 (写出含有字母的表达式)。
[化学一选修3:物质结构与性质]第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1)基态Ni原子核外电子排布式为_______;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________。金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)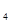 ,该分子呈正四面体构型。试推测Ni(CO)
,该分子呈正四面体构型。试推测Ni(CO) 的晶体类型为________,Ni(CO)
的晶体类型为________,Ni(CO) 易溶于下列_______(填选项字母)中。
易溶于下列_______(填选项字母)中。
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
(2)FeO、NiO晶体中r(Ni2+)和r(Fe2+)分别为69 pm和78 pm,则熔点NiO_________FeO(填“>”或“<”),原因为_____________;黄血盐是一种配合物,其化学式为K4[Fe(CN)6] ·3H2O,该配合物中配体的化学式为_________,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_______________。
(3)酸性高锰酸钾溶液能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20 水中的溶解度之比为0.39,其原因为_________。
水中的溶解度之比为0.39,其原因为_________。
(4)在铬的硅酸盐中,SiO44-四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为________,其化学式为_________。
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是 。(填字母)
A.HCHO与水分子间能形成氢键
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.苯分子中含有6个 键和1个大
键和1个大 键,苯是非极性分子
键,苯是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元 素 |
Mn |
Fe |
|
| 电离能 /kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
Mn元素价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(3)铁原子核外有__________种运动状态不同的电子。
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。
(5)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为 。

(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为 。
②与CNO-互为等电子体微粒的化学式为 (写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
选修:物质结构与性质】(铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置 ______
(2)k3[Fe(CN)6]溶液可用于检验 ______(填离子符号)CN-中碳原子杂化轨道类型为 ____,C、N、O三元素的第一电离能由大到小的顺序为 ___(用元素符号表示)。
(3)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于____________(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=____________。Fe(CO)x在一定条件下发生反应:Fe(CO)x(s) Fe(s)+xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有 _________。
Fe(s)+xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有 _________。
(4)铜晶体铜碳原子的堆积方式如右图所示。


①基态铜原子的核外电子排布式为 ________________。
②每个铜原子周围距离最近的铜原子数目 。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子)。
①该晶体的化学式为 。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 _______(填“离子”、“共价”)化合物。
③已知该晶体的密度为 g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为 ________________pm(只写计算式)。
g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为 ________________pm(只写计算式)。
【化学——选修3:物质结构与性质】
(1)按已知的原子结构规律,27号元素在周期表中的位置是 ,其价电子的轨道排布图为 。
(2)若en代表乙二胺(  ),则配合物[Pt(en)2]Cl4中心离子的配位原子数为 。
),则配合物[Pt(en)2]Cl4中心离子的配位原子数为 。
(3)BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在。它们的结构简式如下,指出Be的杂化轨道类型。
①  ②
② 
③ 
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得。BP晶胞如图所示。

①画出三溴化硼和三溴化磷的空间结构式。
三溴化硼
三溴化磷
②在BP晶胞中B的堆积方式为 。
③计算当晶胞晶格参数为478pm(即图中立方体的每条边长为478pm)时磷化硼中硼原子和磷原子之间的最近距离 。
卤族元素的单质和化合物很多,请用物质结构与性质的相关知识回答:
(1)在一定浓度的氢氟酸溶液中,存在(HF)n缔合分子,使HF分子缔合的作用力是___。
(2)ClO4-中心氯原子的杂化方式为_____,离子的立体构型为__________。
(3)已知碘酸(HIO3)和高碘酸(H5IO6)的分子结构分别如图I、II所示:请比较酸性强弱:HIO3_____H5IO6(填“>”、“<”或“=”)。H5IO6分子中σ键与π键的个数比为 。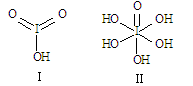
(4)下图为碘晶体晶胞结构。有关说法中正确的是___。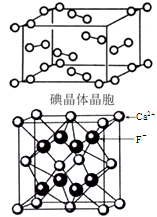
| A.用均摊法可知平均每个晶胞中有4个碘原子 |
| B.碘晶体中分子的配位数为12,具有分子密堆积特征 |
| C.碘晶体中存在的相互作用有非极性键和范德华力 |
| D.碘晶体中碘分子有3种排列方向 |
(5)观察CaF2晶胞结构,判断F-占据Ca2+ 形成的 面体空隙中,Ca2+ 占据F-形成的 面体空隙中。若相邻两个Ca2+ 的核间距为a cm,晶胞密度为ρ g/cm3,NA为阿伏加德罗常数,则CaF2的摩尔质量可以表示为________g/mol。
【化学——选修3 物质结构与性质】选考下图为元素周期表的一部分,字母下方数值为该元素电负性,根据信息回答下列问题(用相应元素符号进行答题):
(1)b、h两元素可形成化合物bh2,写出其电子式: 。
(2)e、g两元素可形成两种化合物eg3、e2g6,eg3的分子构型为 ,eg3、e2g6中心原子e的杂化方式分别为 、 。
(3)d元素形成的单质可与g的氢化物浓溶液在加热条件下反应生成一种以二价d离子为内界中心原子(配位数为4)的配位化合物与一种可燃性气体,写出反应的化学方程式: 。
(4)f、g、h、i四种元素对应单质分子的键能如下表:
| 共价键 |
f—f |
g—g |
h—h |
i—i |
| 键能(kJ/mol) |
157 |
242.7 |
193.7 |
152.7 |
试从原子半径角度阐述f—f键键能反常的原因: 。
(5)c元素的元素符号是 ,价电子排布式为 ,下图是
一种受到较多关注的c元素单质与金属镧(La)形成的储氢材料的结构示意图,请在图中勾画出该晶体的一个晶胞。计算出该合金的化学式为: 。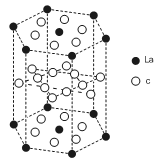
【化学—选修3物质结构与性质】已知:碳、氮、氢、氧四种元素可形成多种化合物,且有非常重要的用途。
(1)C、N、H电负性的大小顺序为 。
(2)甲烷与二氧化氮可发生如下反应:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) ,若反应中有2mol C-H键断裂,则形成的π键共有 mol。
(3)F2与NH3在一定条件下可形成NF3,NF3分子的空间构型为 形 。
(4)现已合成出一种硬度比金刚石还大的晶体氮化碳,其化学式为 。其硬度比金刚石大的主要原因是 。
(5)配合物Y的结构如图所示,Y中含有 (填序号)。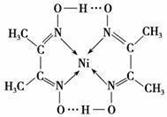
A.非极性共价键
B.配位键
C.极性键
D.氢键
E.金属键
Y中碳原子的杂化方式有 。
写出镍(Ni)原子的价电子排布式 。
(6)氨气与铁在一定条件下发生置换反应,一种产物的晶胞结构如下图所示,若该立方体晶胞的棱长为a pm,则该晶体的密度为 g/cm3(NA为阿佛加德罗常数的值)。