(本题15分)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途.请回答以下问题:
(1)Cu+基态核外电子排布式为
(2)与OH-互为等电子体的一种分子为 (填化学式)。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为__________。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为___________;
(4)Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因_________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(6)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
(7)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu===2Fe2++Cu2+,请写出其第l步反应的离子方程式__________________________________。
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)Se原子中电子占据的最高能层符号是________,该能层具有的原子轨道数为 ,其核外M层电子的排布式为________;
(2)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是________;
(3)H2Se的酸性比H2S________(填“强”或“弱”)。气态SeO3分子的立体构型为________,SO42-离子的立体构型为________;
(4)含氧酸可表示为:(HO)mROn,酸的强度与酸中的非羟基氧原子数n有关,n越大,酸性越强。一般n="0" 弱酸,n="1" 中强酸,n=2强酸,n="3" 超强酸。
据实验事实可知硼酸(H3BO3)是一元弱酸,而亚磷酸是中强酸(H3PO3)
①写出硼酸(H3BO3)的电离方程式 。
②写出亚磷酸与过量的NaOH反应的化学方程式 。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,ZnS的密度为d g·cm-3,则其晶胞中a位置S2-离子与b位置Zn2+离子之间的距离为________pm(列式表示)。
锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛。
(1)Li-SOCl2电池总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2,该反应的反应物和生成物中不存在的相互作用是 (填序号)。
a.离子键
b.共价键
c.氢键
d.范德华力
e.金属键
(2)亚硫酰氯(SOCl2)中硫的化合价为 ,1molSOCl2中的σ键数目是 。S、O、Cl三种元素电负性从大到小的顺序是 。
(3)在Li-SOCl2电池的碳正极中加入金属酞菁配合物可提高电池的容量和寿命。右图为一种铁酞菁配合物的结构,其中M为Fe2+,写出Fe2+的价电子排布式 。请在图中用箭头表示出配位键。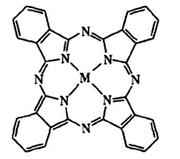
(4)人们发现Li+溶剂化倾向和形成共价键倾向很强,提出类似氢键的锂键。如LiF·HF中就存在锂键,下列LiF·HF的结构式正确的是(其中锂键用…表示) 。(填序号)
a. F—H…Li—F b.H—F…Li—F
有以下六种元素:A是宇宙中最轻的元素。D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3P轨道后,3P轨道呈全充满状态。G原子2P轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数差8.
L位于周期表第四周期、第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如图所示,
请回答下列问题:
(1)E元素的电负性____________(填“>”“<”或“=”)M元素的电负性。
(2)G的第一电离能比它同周期前一族相邻元素的第一电离能____________(填“大”或“小”)。
(3)M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是__________,M2E2是___________(填“极性”或“非极性”)分子。
(4)L的外围电子排布式为____________,该元素位于周期表中的____________族。
(5)R的化学式为________________(用元素符号表示),属于____________晶体。
已知R晶体的密度为ρ g.cm-3,则该晶胞的边长a____________cm。(阿常数用NA表示)
[化学——选修3:物质结构与性质](15分)As、N、O等非金属元素的化合物在工业生产中有重要的应用。
(1)核电荷数比As小4的元素基态原子的电子排布式为 。
(2)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有 种。
(3)已知氮的最高价氧化物为无色晶体.它由两种离子构成,其阴离子构型为平面正三角形,则其阳离子的构型为 形,阳离子中氮的杂化方式为 。
(4)磷化硼有多种晶型,下图示意的是磷化硼分子的分子结构图,其分子式为 。
(5)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如下图所示。由此判断该钙的氧化物的化学式为 。已知该氧化物的密度是ρg·cm -3.则晶胞离得最近的两个钙离子间的距离为 cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,E2+核外电子有18种运动状态,F+的三个能层电子全充满。下表是主要化合价及原子半径数据:
| |
A |
B |
C |
D |
E |
F |
| 主要化合价 |
-1 |
-3 +5 |
-2 +6 |
-1 +7 |
+2 |
+1 +2 |
| 原子半径 |
0.071 |
0.11 |
0.102 |
0.099 |
0.197 |
0.117 |
(1)B、C、D三种元素第一电离能数值由小到大的顺序是 (填元素符号);
(2)F2+与NH3 形成配离子的结构式为 ;该配离子具有对称的空间构型,其中两个NH3被两个Cl-取代,能得到两种不同结构的产物,则该配离子的空间构型为 。往某种蓝色溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,可得到含有上述配离子的配合物。写出沉淀溶解的离子方程式 。
(3)A 、E两种元素形成晶体晶胞是下图中的 (填①、②、③或④);
(4)下图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,请选出A的氢化物所在的折线 (填n、m、x或y)。
[化学—物质结构与性质]选做人类生活和工业生产都离不开金属。请根据相关信息回答:
(1)235U可用于核能发电。科学家们采用“气体扩散法”从UF6 获得高浓度的235U。已知UF6在常温常压下是固体,在56.4℃升华成气体,说明UF6属于 晶体。
(2)某丁香酸金属铜配合物的结构简式如下图所示,请回答。
该化合物中碳原子的杂化方式有 ,Cu原子的外围电子排布式 。
(3)某铜的配合物在煤的液化中起催化作用,其阳离子结构如下图。
①在该离子内部含有的化学键类型有 (填字母)。
a.离子键
b.极性键
c.非极性键
d.配位键
e.范德华力
f.氢键
②煤液化获得的甲醇经催化氧化可得到重要工业原料甲醛(HCHO)。甲醇的沸点 64.96℃,甲醛的沸点-21℃,甲醛的沸点更低的原因是分子间没有氢键。你认为甲醛分子间没有氢键的原因是 。
③甲醛分子σ键和π键的个数比为 。
(4)具有6 配位的Co3+的配合物[Co(NH3)mCln]Cl(3-n)具有一定的抗肿瘤活性。1 mol该配合物与足量AgNO3溶液反应生成2 mol AgCl沉淀,则m= 、n= 。
(15分) A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大。A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1 ="578" kJ/mol,I2="1" 817 kJ/mol,I3=" 2" 745 kJ/mol,I4 ="11" 575 kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34。请回答下列问题:
(1)AY2是一种常用的溶剂,为 分子(填“极性”或“非极性”),分子中存在 个σ键。
(2)X形成的单质与NaOH溶液反应的离子方程式为 超高导热绝缘耐高温纳米XB在绝缘材料中应用广泛,其晶体与金刚石类似,属于 晶体。B的最简单氢化物容易液化,理由是 。
(3)X、氧、B元素的电负性由大到小的顺序为 (用元素符号作答) 。
(4)Z的基态原子核外电子排布式为 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2, HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示不正确的是 (填序号)
①氧化剂是O2
②HO2在碱中不能稳定存在
③氧化产物是HO2
④1 mol Z参加反应有1 mol电子发生转移
(5)已知Z的晶胞结构如下图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 cm。ZYO4常作电镀液,其中YO42-的空间构型是 ,Y原子的杂化轨道类型是 杂化。

【化学—物质结构与性质】石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)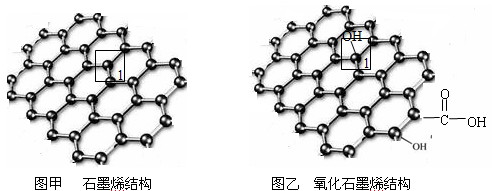
(1)图甲中,1号C与相邻C形成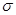 键的个数为____________________________。
键的个数为____________________________。
(2)图乙中,1号C的杂化方式是________________,该C与相邻C形成的键角_______(填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。
(3)若将图乙所示的氧化石墨烯分散到H2O中,则氧化石墨烯可与H2O形成氢键的原子有_________(填元素符号)。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为_____________,该材料的化学式为__________。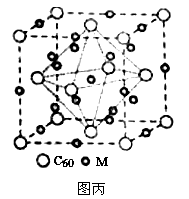
(物质结构与性质)
Ⅰ.下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)请写出元素D的基态原子电子排布式___________________。
(2)元素A、B形成的单质中,______对应的单质熔点更高,原因是_________________。
(3)写出C的最高价氧化物的水化物与B的最高价氧化物的水化物反应的化学方程式_______________。
(4)元素D可以形成化学式为D(NH3)5BrSO4,配位数均为6的两种配合物。若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为____________。
Ⅱ.钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态:+2价和+3价。
(5)根据图示晶胞结构,推算晶体中Y,Ba,Cu和O原子个数比,确定其化学式为________。
Ⅲ.BF3与一定量的水形成晶体Q [(H2O)2·BF3],Q在一定条件下可转化为R: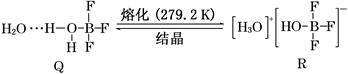
(6)晶体Q中各种微粒间的作用力不涉及________(填字母)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.范德华力
(7)R中阳离子的空间构型为________,阴离子的中心原子轨道采用_____杂化。
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是 。(填字母)
A.HCHO与水分子间能形成氢键
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.苯分子中含有6个 键和1个大
键和1个大 键,苯是非极性分子
键,苯是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元 素 |
Mn |
Fe |
|
| 电离能 /kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
Mn元素价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(3)铁原子核外有__________种运动状态不同的电子。
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。
(5)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为 。

(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为 。
②与CNO-互为等电子体微粒的化学式为 (写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
选修:物质结构与性质】(铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置 ______
(2)k3[Fe(CN)6]溶液可用于检验 ______(填离子符号)CN-中碳原子杂化轨道类型为 ____,C、N、O三元素的第一电离能由大到小的顺序为 ___(用元素符号表示)。
(3)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于____________(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=____________。Fe(CO)x在一定条件下发生反应:Fe(CO)x(s) Fe(s)+xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有 _________。
Fe(s)+xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有 _________。
(4)铜晶体铜碳原子的堆积方式如右图所示。


①基态铜原子的核外电子排布式为 ________________。
②每个铜原子周围距离最近的铜原子数目 。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子)。
①该晶体的化学式为 。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 _______(填“离子”、“共价”)化合物。
③已知该晶体的密度为 g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为 ________________pm(只写计算式)。
g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为 ________________pm(只写计算式)。
【化学——选修3:物质结构与性质】
(1)按已知的原子结构规律,27号元素在周期表中的位置是 ,其价电子的轨道排布图为 。
(2)若en代表乙二胺(  ),则配合物[Pt(en)2]Cl4中心离子的配位原子数为 。
),则配合物[Pt(en)2]Cl4中心离子的配位原子数为 。
(3)BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在。它们的结构简式如下,指出Be的杂化轨道类型。
①  ②
② 
③ 
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得。BP晶胞如图所示。

①画出三溴化硼和三溴化磷的空间结构式。
三溴化硼
三溴化磷
②在BP晶胞中B的堆积方式为 。
③计算当晶胞晶格参数为478pm(即图中立方体的每条边长为478pm)时磷化硼中硼原子和磷原子之间的最近距离 。
卤族元素的单质和化合物很多,请用物质结构与性质的相关知识回答:
(1)在一定浓度的氢氟酸溶液中,存在(HF)n缔合分子,使HF分子缔合的作用力是___。
(2)ClO4-中心氯原子的杂化方式为_____,离子的立体构型为__________。
(3)已知碘酸(HIO3)和高碘酸(H5IO6)的分子结构分别如图I、II所示:请比较酸性强弱:HIO3_____H5IO6(填“>”、“<”或“=”)。H5IO6分子中σ键与π键的个数比为 。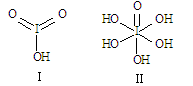
(4)下图为碘晶体晶胞结构。有关说法中正确的是___。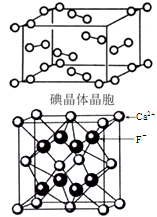
| A.用均摊法可知平均每个晶胞中有4个碘原子 |
| B.碘晶体中分子的配位数为12,具有分子密堆积特征 |
| C.碘晶体中存在的相互作用有非极性键和范德华力 |
| D.碘晶体中碘分子有3种排列方向 |
(5)观察CaF2晶胞结构,判断F-占据Ca2+ 形成的 面体空隙中,Ca2+ 占据F-形成的 面体空隙中。若相邻两个Ca2+ 的核间距为a cm,晶胞密度为ρ g/cm3,NA为阿伏加德罗常数,则CaF2的摩尔质量可以表示为________g/mol。
【化学——选修3 物质结构与性质】选考下图为元素周期表的一部分,字母下方数值为该元素电负性,根据信息回答下列问题(用相应元素符号进行答题):
(1)b、h两元素可形成化合物bh2,写出其电子式: 。
(2)e、g两元素可形成两种化合物eg3、e2g6,eg3的分子构型为 ,eg3、e2g6中心原子e的杂化方式分别为 、 。
(3)d元素形成的单质可与g的氢化物浓溶液在加热条件下反应生成一种以二价d离子为内界中心原子(配位数为4)的配位化合物与一种可燃性气体,写出反应的化学方程式: 。
(4)f、g、h、i四种元素对应单质分子的键能如下表:
| 共价键 |
f—f |
g—g |
h—h |
i—i |
| 键能(kJ/mol) |
157 |
242.7 |
193.7 |
152.7 |
试从原子半径角度阐述f—f键键能反常的原因: 。
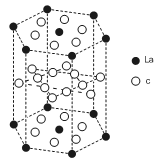
(5)c元素的元素符号是 ,价电子排布式为 ,下图是
一种受到较多关注的c元素单质与金属镧(La)形成的储氢材料的结构示意图,请在图中勾画出该晶体的一个晶胞。计算出该合金的化学式为: 。