I、右图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:
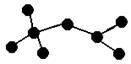
(1)用系统命名法命名 。
(2)M的一氯代物有 种。
(3)含有一个甲基和一个乙基的M的同分异构体有 种。
Ⅱ、利用右图装置还可以验证醋酸、苯酚、碳酸的酸性强弱。

(4)A中固体试剂是 (选填字母);
a.醋酸钠 b.碳酸氢钠 c.苯酚钠
(5)C中反应的化学方程式是: ;
(6)有同学认为没有B装置,也可以验证酸性的强弱,
这种认为是不合理的,原因是 。
下图为实验室制备乙酸乙酯的装置。


 已知下列数据:
已知下列数据:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
| 乙醇 |
-114 |
78 |
0.789 |
| 乙酸 |
16.6 |
117.9 |
1.05 |
| 乙酸乙酯 |
-83.6 |
77.5 |
0.900 |
| 浓H2SO4 |
|
338 |
1.84 |
 (1)写出试管a中主要发生反应的化学方程式 。
(1)写出试管a中主要发生反应的化学方程式 。
(2)导管要插在试管b中饱和Na2CO3溶液的液面以上,原因是: 。
 (3)试管b中饱和Na2CO3的作用: 。
(3)试管b中饱和Na2CO3的作用: 。
 (4)开始用小火加热试管a中的混合液,其原因是__ 。
(4)开始用小火加热试管a中的混合液,其原因是__ 。
(5)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有 (填序号)。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
 (6)若120 g乙酸和184 g乙醇反应生成106 g 乙酸乙酯,则该反应的产率为________。
(6)若120 g乙酸和184 g乙醇反应生成106 g 乙酸乙酯,则该反应的产率为________。
苯甲酸是一种重要的化工原料。实验室合成苯甲酸的原理、有关数据及装置示意图如下: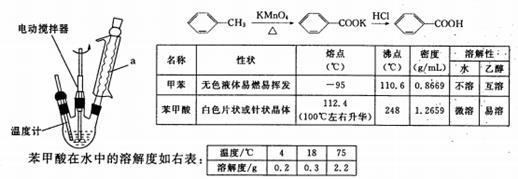
草酸(H2C2O4)为易溶于水的固体
某学习小组在实验室制备、分离、提纯苯甲酸,并测定所得样品的纯度,步骤如下:
一、制备苯甲酸
在三颈瓶中加人2.7mL甲苯、100mL水和2~3片碎瓷片,开动电动搅拌器,a中通入流动水,在石棉网上加热至沸腾,然后分批加入8.5g高锰酸钾,继续搅拌约4~5h,直到甲苯层几乎近于消失、回流液不再出现油珠,停止加热和搅拌,静置。
二、分离提纯
在反应混合物中加入一定量草酸充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,然后用浓盐酸酸化,苯甲酸全部析出后减压过滤,将沉淀物用少量冷水洗涤,挤压去水分后放在沸水浴上干燥,得到粗产品。
三、测定纯度
称取mg产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3滴酚酞,然后用标准浓度KOH溶液滴定。
请回答下列问题:
(1)装置a的名称是____________,其作用为______________________。
(2)甲苯被高锰酸钾氧化的原理为: 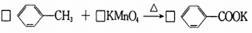
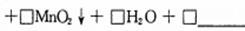 ,
,
请完成并配平该化学方程式。
(3)分离提纯过程中加人的草酸是一种二元弱酸,反应过程中有酸式盐和无色气体生成。加入草酸的作用是_______,请用离子方程式表示反应原理_________________________。
(4)产品减压过滤时用冷水洗涤的原因是________________________。
(5)选用下列__________操作,可以将粗产品进一步提纯。(选填字母)
| A.溶于水后过滤 | B.溶于乙醇后蒸馏 | C.用甲苯萃取后分液 | D.升华 |
(6)测定纯度步骤中,滴定终点溶液的颜色变化是______________。若m=1.200g,滴定时用去0.1200mol· L-1标准KOH溶液20.00mL,则所得产品中苯甲酸的质量分数为_______________。
可用图示装置制取少量乙酸乙酯。已知乙酸乙酯的沸点低于乙醇。请填空:

(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是 。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是 。
(3)实验中加热试管a的目的是:
① ;
② 。
(4)试管b中加有饱和Na2CO3溶液,其作用是 。
(5)试管b中导气管不伸入液面下的原因是 。
羟基是重要的官能团。某化学小组以下列4种物质的溶液作为研究对象,比较不同物质的羟基中氢原子的活泼性。①碳酸 ②乙醇 ③苯酚 ④乙酸
I.甲同学设计并实施了如下实验方案,请完成(1)(2)(3)(4)的填空及结论。
| 编号 |
实验操作 |
实验现象 |
结论及解释 |
| 1 |
分别取4种溶液,滴加紫色石蕊溶液 |
溶液变红的是①④溶液 |
略 |
| 2 |
向含酚酞的NaOH溶液中,各滴加等量的②③两种溶液 |
②中无明显现象 ③中红色明显变浅 |
滴加③时反应的化学方程式: (1)___________ |
| 3 |
用一定浓度的醋酸溶液浸泡水垢(水垢主要成分为碳酸钙) |
(2)__________ |
略 |
| 4 |
将CO2通入C6H5ONa溶液中 |
(3)__________ |
反应的化学方程式: (4)_____________ |
| 结论: 4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)_____________。 |
II.乙同学在研究了甲同学的实验方案后,提出如下改进方案,能一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如下图所示。

(1)利用上述仪器组装实验装置,其中A管插入(填字母,下同)_______中,B管插入E中,C管插入_________中。
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有_____________溶液的洗气装置,使乙同学的实验设计更加完善。
草酸亚铁晶体的化学式为FeC2O4·2H2O,它是一种淡黄色结晶粉末,有轻微刺激性,加热时可发生如下分解反应:FeC2O4·2H2O FeO +CO2↑+CO↑+H2O
FeO +CO2↑+CO↑+H2O
(1)请你用下图中提供的仪器(可以重复选用,但每种仪器至少选用一次),选择必要的试剂[供选择的试剂:NaOH溶液、澄清石灰水、饱和碳酸钠溶液、CuO、无水硫酸铜、酸性高锰酸钾溶液],设计一个实验,检验FeC2O4·2H2O加热时分解产生的气态产物(包括水蒸气)(部分加热装置和夹持仪器在图中略去)。在答题卡上填写下表(可以不用填满,也可以补充)。
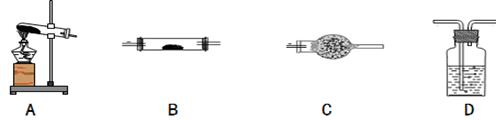
| 仪器符号 |
仪器中所加物质 |
作用 |
| A |
草酸亚铁晶体 |
加热草酸亚铁晶体得到气体产物 |
| |
|
|
| |
|
|
| D |
NaOH溶液 |
|
| |
|
|
| |
|
|
| |
|
|
| |
|
|
(2)按照题目提供的装置和要求设计的实验明显存在的一个不足是 。
(3)反应结束后,在A装置试管中有黑色固体粉末(混合物)产生,倒出时存在燃烧现象,产生上述现象的可能原因是 。
某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为___________________________。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
_____MnO4-+_____H2C2O4+____H+ = ____Mn2++_____CO2+____H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
上述装置中,D的作用是______。乙二酸分解的化学方程式为__________。
(4)该小组同学将2.52g草酸晶体(H2C2O4·2 H2O)加入到100mL0.2mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是_______(用文字简单描述)。
(5)以上溶液中各离子的浓度由大到小的顺序为:_________(用离子符号表示)。
(11分) 芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难以氧化,而环上的支链不论长短,在强烈氧化时,最终能氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。
反应原理:

反应试剂、产物的物理常数:
| 名称 |
相对分 子质量 |
性状 |
熔点 |
沸点 |
密度 |
溶解度 |
||
| 水 |
乙醇 |
乙醚 |
||||||
| 甲苯 |
92 |
无色液体易燃易挥发 |
-95 |
110.6 |
0.8669 |
不溶 |
易溶 |
易溶 |
| 苯甲酸 |
122 |
白色片状或针状晶体 |
122.4 |
248 |
1.2659 |
微溶 |
易溶 |
易溶 |
主要实验装置和流程如下:

实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。

(1)操作Ⅰ所需的玻璃仪器为________________;操作Ⅱ为______________。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是__________________________。
(3)下列关于仪器的组装或者使用正确的是________。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入_________,分液,水层再加入 ,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220 g产品,配成100 mL溶液,取其中25.00 mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为______________。
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。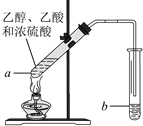
(1)乙醇分子官能团名称是_______________。
(2)试管A中加入几块碎瓷片的目的是___________。
(3)试管A中发生反应的化学方程式为 ___________,反应类型是_______。
(4)反应开始前,试管B中盛放的溶液是____________。作用是___________。
(5)可用_________的方法把制得的乙酸乙酯分离出来。
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定。学习小组的同学设计了滴定的方法测定x值。
①称取2.520 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.100 0 mol·L-1的KMnO4标准溶液进行滴定,达到终点时消耗20.00 mL。
(1)写出草酸(H2C2O4)与酸性高锰酸钾溶液反应的化学方程式____________。
(2)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
(3)本实验滴定达到终点的标志是__________。
(4)通过上述数据,求得x=________。
讨论:①若滴定终点时仰视滴定管刻度,则由此测得的x值会_______(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求填写下列空格:
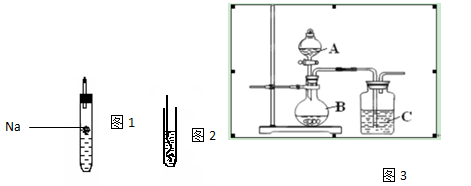
(I)如上图1所示,试管中装乙醇,(图示不一定准确)则反应现象为 ;
(II)如上图2所示,把加热的铜丝插入到装有乙醇的试管中,闻到有刺激性气味,该反应中产生的有机物为 ;(填结构简式);
(III)为了确认乙酸、碳酸和硅酸的酸性强弱,有人设计用如图3所示装置来进行实验验证。
①A中所盛试剂为___ ____。
②C中实验现象为 ,由实验可知这三种酸的酸性大小为 。
③该装置中存在不妥之处,请提出改正措施 。
已知下列数据:
| 物质 |
熔点(℃) |
沸点(℃) |
密度(g·cm-3) |
| 乙醇 |
-117.0 |
78.0 |
0.79 |
| 乙酸 |
16.6 |
117.9 |
1.05 |
| 乙酸乙酯 |
-83.6 |
77.5 |
0.90 |
| 浓硫酸(98%) |
— |
338.0 |
1.84 |
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10 min;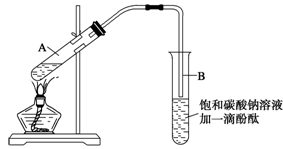
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥。
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为_______________________。
写出制取乙酸乙酯的化学方程式:______________________。
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)__________ __________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是________________________。
(4)分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)______。
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸。反应原理如下:
C6H5-CH3+2KMnO4 C6H5-COOK+KOH+2MnO2↓+H2O
C6H5-COOK+KOH+2MnO2↓+H2O
C6H5-COOK+HCl→ C6H5-COOH+KCl
已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866 g·cm-3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3 g和6.9 g。
【制备产品】30.0 mL甲苯和25.0 mL 1 mol·L-1高锰酸钾溶液在80℃下反应30 min,装置如图所示:
(1)图中支管的作用是_______________________。
(2)在本实验中,三颈烧瓶最合适的容积是________(填字母)
| A.50 mL | B.100 mL | C.200 mL | D.250 mL |
【分离产品】他们设计如下流程分离粗产品苯甲酸和回收甲苯:
(3)操作Ⅰ的名称是____;含杂质的产物经操作Ⅱ进一步提纯得无色液体A,则操作Ⅱ的名称是_______。
(4)操作Ⅲ的名称是____。检验B中是否含有Cl-的方法如下:取少量B溶于水,在上层清液中滴加稀硝酸酸化的________溶液,若产生白色沉淀,则B中含有Cl-。
乙二酸( HOOC—COOH)俗称草酸,易溶于水,,电离常数K1=5.4×10-2,K2=5.4×10-5,其盐草酸钙和草酸氢钙均为白色不溶物。无色晶体H2C2O4·2H2O称为草酸晶体,其熔点为101.5℃。草酸晶体失去结晶水得无水草酸,它在157℃升华。根据上述信息,回答下列问题。
(1)向盛有2mL饱和NaHCO3溶液的试管里加入少量乙二酸浓溶液,观察到有大量气泡产生,写出该反应的离子方程式: 。(碳酸:K1=4.4×10-7)
(2)向试管A中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙二酸溶液,按下图Ⅰ组装好装置,加热3—5min。在装有饱和Na2CO3溶液的试管B中有油状且带有香味的液体产生。B中导管口在液面上而不伸入液面下的原因是 。写出乙二酸与少量乙醇反应的化学反应方程式 。
(3)已知草酸分解的化学方程式为:H2C2O4 H2O+CO2↑+CO↑
H2O+CO2↑+CO↑
利用图Ⅱ①和图Ⅱ②加热草酸晶体(夹持仪器忽略),以验证草酸受热是否分解。连续加热一段时间后的现象是:图Ⅱ①:试管里澄清石灰水先变浑浊,后又变澄清;
图Ⅱ②:试管里澄清石灰水只变浑浊。
能验证草酸受热分解的装置是 (填图Ⅱ中的编号“①”或“②”)。
(4)图Ⅱ①中冷凝管的作用是: 。