为了降低某水库的铁闸门被腐蚀的速率,可以采取如右图所示的方案,其中焊接在铁闸门上的固体材料R可以采用
| A.铜 | B.钠 | C.锌 | D.石墨 |
下列有关金属腐蚀与防护的说法正确的是
| A.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程 |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
下列叙述正确的是
| A.氢氧燃料电池中O2通入负极 |
| B.铅蓄电池在放电时,其负极的电极反应为:Pb-2e=Pb2+ |
| C.碱性锌锰电池在工作时,电解质中的OH-移向正极 |
| D.在海轮外壳镶嵌锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
下列现象与电化学腐蚀无关的是
| A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B.生铁比软铁芯(几乎是纯铁)容易生锈 |
| C.铁质器件附有铜质配件,在接触处易生铁锈 |
| D.银质奖牌久置表面变暗 |
埋在地下的自来水管,在下列情况下被腐蚀的速度最慢的是
| A.在含有铁元素的较多的酸性土壤中 |
| B.在潮湿、疏松的土壤中 |
| C.在自来水的铁管上用导线连接一块锌片后,再埋入不透气的土壤中 |
| D.在自来水的铁管上用导线连接一块铜片后,再埋入潮湿、疏松的土壤中 |
如图所示的装置中,金属a能从酸中置换出H2,b为碳棒,关于此装置的各种叙述中不正确的是( )
| A.碳棒上有气体放出,溶液pH值变大 |
| B.a是正极,b是负极 |
| C.导线中有电子流动,电子从a极到b极 |
| D.a极上发生了氧化反应 |
下列说法中正确的是
| A.增大反应物浓度,可逆反应正速率增大;减少反应物浓度,可逆反应逆速率增大 |
| B.粗铜精炼时,电解质液中的c(Cu2+)保持不变 |
| C.纯银在空气中久置变黑发生的是电化学腐蚀 |
| D.阴极电保护法是将被保护的金属与外加电源的负极相连 |
下列关于金属腐蚀正确的是 ( )
A.金属在潮湿空气中的腐蚀的实质是;M+nH2O===M(OH)n+ H2↑ H2↑ |
| B.金属的化学腐蚀的实质是M-ne-===Mn+,电子直接转移给氧化剂 |
| C.金属的化学腐蚀必须在酸性条件下进行 |
| D.在潮湿的中性环境中,金属不会发生电化学腐蚀 |
下列说法正确的是( )
| A.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 |
| B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 |
| C.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 |
D.一定条件下反应N2+3H2 2NH3达到平衡时,3v正(H2)=2v逆(NH3) 2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
下列有关说法正确的是( )
| A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 |
| B.2NO(g)+2CO(g) = N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH<0 |
| C.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
| D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
下列容器中盛有海水,纯铁在其中被腐蚀时,由快到慢的顺序是 ( )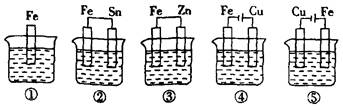
| A.⑤②①④③ | B.③②⑤①④ |
| C.⑤④②③① | D.⑤②①③④ |
关于下列各装置图的叙述中,不正确的是
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
家用铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
| A.4Fe(OH)2+2H2O+O2=4Fe(OH)3 | B.2Fe+2H2O+O2=2Fe(OH)2 |
| C.2H2O+O2+4e- =4OH- | D.Fe-3e-=Fe3+ |
钢铁发生吸氧腐蚀时,正极上发生的电极反应是 ( )
A.2H +2e +2e =H =H ↑ ↑ |
B.Fe +2e=Fe +2e=Fe |
C.2H 0+0 0+0 +4e +4e =40H =40H |
D.Fe e e = Fe = Fe |