下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是
| A.④>②>①>③ | B.②>①>③>④ | C.④>②>③>① | D.③>②>④>① |
镀锌铁在发生析氢腐蚀时,若有0.2 mol电子发生转移,下列说法中正确的是( )
①有5.6 g金属被腐蚀 ②有6.5 g金属被腐蚀
③在标准状况下有2.24 L气体放出 ④在标准状况下有1.12 L气体放出
| A.①② | B.②③ | C.①④ | D.③④ |
右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和稀盐酸,各加入生铁块,放置一段时间。下列有关描述错误的是
| A.生铁块中的碳是原电池的正极 |
| B.红墨水柱两边的液面变为左低右高 |
| C.两试管中相同的电极反应式是:Fe-2e-=Fe2+ |
| D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |
(16分)对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是 (用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,电解后取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因是 (用离子方程式表示)
(2)镀铜可防止铁制品腐蚀,电镀时用 来做阳极。
(3)利用如图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应放于 处,写出X极的电极反应
若X为碳棒,开关K置于M处,写出X极的电极反应
(1)X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸盐溶液中,Y表面有Z析出。其活泼顺序是_________________;
(2)由氢气和氧气反应生成1mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:___________________________ _______。
(3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是 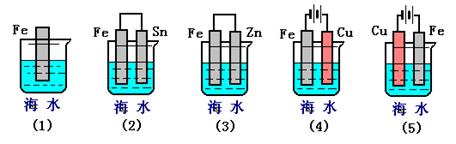
(1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在空气酸度不大的环境中,该原电池的负极是 ,负极反应式为 ;正极是 ,正极反应式为 。
(2)下列装置中,能对Fe片腐蚀起防护作用的有(用序号表示) 
如图是稀酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是
| A.稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱 |
| B.稀硝酸和铁反应的化学方程式是Fe+6HNO3(稀)= Fe(NO3)3 + 3NO2↑+ 3H2O |
| C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 |
| D.随着Cr含量增加,稀硝酸对Fe-Cr合金的腐蚀性减弱 |
下列事实不能用电化学理论解释的是
| A.轮船水线以下的船壳上装一定数量的锌块 |
| B.铝片不用特殊方法保存 |
| C.纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
| D.镀锌的铁比镀锡的铁耐用 |
据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是
| A.Fe -2e-=Fe2+ | B.2H2O+O2+4e-=4OH- |
| C.4OH-- 4e-=2H2O+O2↑ | D.2H++2e-=H2↑ |
写出下列反应的热化学方程式或电极反应式:
(1)N2(g)与H2(g)反应生成1molNH3(g),放出46.1kJ热量 。
(2)钢铁发生吸氧腐蚀时的正极电极反应式 。
(3)CH4与O2在酸性条件下形成原电池时,负极的电极反应式 。
下列叙述不正确的是
| A.生铁中含有碳,抗腐蚀能力比纯铁弱 |
| B.用锡焊接的铁质器件,焊接处易生锈 |
| C.在铁制品上镀铜时,镀件(待镀金属)为阳极,铜盐为电镀液 |
| D.铁制钥匙表面镀上一层锌,钥匙不易被腐蚀 |
如图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是
| A.铁丝在两处的腐蚀速率:a < b |
| B.a、b两处相同的电极反应式为Fe-2e-==Fe2+ |
| C.一段时间后,a处液面高于b处液面 |
| D.生铁丝中的碳在a、b两处分别作原电池的负极和正极 |