如图所示的钢铁的析氢腐蚀与吸氧腐蚀中,下列说法正确的是( )

| A.碳表面发生氧化反应 |
| B.钢铁被腐蚀的最终产物为FeO |
| C.生活中钢铁制品的腐蚀以图①所示为主 |
| D.图②中,正极反应式为O2+4e-+2H2O===4OH- |
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁
年产量的1/4。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式。
正极: ;负极: 。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用下图所示甲的方案,其中焊接在铁闸门的固体材料R可以采用 。(请写出具体金属名称)
(3)下图中乙方案也可降低铁闸门腐蚀速率,其中铁闸门应该连接在直流电源
的 极。
下列说法正确的是
| A.强电解质一定易溶于水 |
| B.钢铁在海水中发生电化腐蚀时,铁是阳极被氧化 |
| C.对可逆反应,升高温度一定存在v(正)>v(逆) |
| D.相同浓度时,强酸中水的电离程度比弱酸的水的电离程度小 |
表明金属甲比金属乙活动性强的叙述正确的是
| A.在氧化还原反应中,甲失电子数比乙多 | B.将甲、乙组成原电池时,甲为正极 |
| C.甲不能与盐酸反应放出H2,而乙能 | D.甲、乙最高价氧化物的水化物碱性:甲>乙 |
下列现象与电化学腐蚀无关的是
| A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B.生铁比软铁芯(几乎是纯铁)容易生锈 |
| C.铁质器件附有铜质配件,接触处容易生铁锈 |
| D.银质奖牌放置久了表面变暗 |
下列叙述正确的是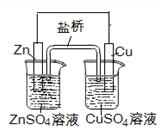
| A.电镀时,通常把待镀的金属制品作阳极 |
| B.上图Zn为负极,发生还原反应 |
| C.上图电子由Zn电极流向Cu电极,盐桥中的Cl-移向CuSO4溶液 |
| D.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为:O2+4H++4e-= 2H2O |
家用炒菜锅用水清洗后,出现红棕色的锈斑。此变化过程不发生的化学反应是
| A.4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 |
| B.2Fe + 2H2O +O2 = 2Fe(OH)2 |
| C.负极反应:Fe —3e- = Fe3+ |
| D.正极反应:2H2O + O2 + 4e--=4OH— |
下列叙述正确的是
| A.合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 |
| B.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液 |
| C.将NO2、N2O4混合气体的体积压缩为原来的一半,则气体颜色加深 |
| D.牺牲阳极的阴极保护法和外加直流电的阴极保护法都是应用电解原理 |
下列有关说法正确的是
| A.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
| B.常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0 |
| C.在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 |
| D.加热0.1 mol·L-1Al2(SO4)3溶液,水解程度增大、溶液的酸性增强 |
化学品船是建造或改装用于运载各种有毒、易燃、易挥发或有腐蚀性的化学物质的货船,下列说法错误的是
| A.在船舶的底部四周镶嵌铜块以保护船体 |
| B.不锈钢船舱可储藏运输散装氢氧化钠溶液 |
| C.甲醇与浓硫酸必须分开储藏运输 |
| D.造船焊接钢板时可用二氧化碳保护气 |
制造焊锡时,把铅加进锡的重要原因是
| A.增加强度 | B.降低熔点 | C.增加硬度 | D.增强抗腐蚀能力 |
有如右图装置,下列有关该装置的叙述正确的是:
| A.锌极附近滴入酚酞,溶液呈红色。 |
| B.铁极发生的电极反应为:2H2O+O2+4e=4OH- |
| C.铁极发生了吸氧腐蚀 |
| D.溶液中的OH-离子向铁极移动 |
在面盆、痰盂等铁制品表面烧制搪瓷的目的是
| A.防止铁生锈且美观 | B.增大厚度防止磨损 |
| C.增大硬度防止撞坏 | D.美观及杀菌消毒作用 |