广东省肇庆市高三一模化学试卷
下列变化过程,属于放热过程的是
| A.酸碱中和反应 | B.液态水变成水蒸气 |
| C.弱酸弱碱电离 | D.用FeCl3饱和溶液制Fe(OH)3胶体 |
下列关于有机物的说法正确的是
| A.涤纶、纤维素、酚醛树脂都是合成材料 |
| B.汽油和植物油都是混合物,主要成份是烃和酯 |
| C.甲酸与乙酸是有机酸,都不能被酸性高锰酸钾溶液氧化 |
| D.葡萄糖、蔗糖、淀粉在一定条件下都可发生水解反应 |
下列各组离子能在水溶液中大量共存的是
| A.H+、Fe2+、ClO-、SO42- | B.Na+、Cu2+、S2-、ClO- |
| C.Na+、Ba2+、OH-、NO3- | D.Na+、Al3+、SiO32-、CO32- |
下列离子方程式书写正确的是
| A.往CaCl2溶液中通入少量的CO2: Ca2++CO2+H2O==CaCO3↓+2H+ |
| B.向碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+ OH-==CO32-+ H2O |
| C.向AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O=A1O2-+4NH4++2H2O |
| D.向Ba(OH)2溶液中加入少量的NaHSO3溶液:HSO3-+Ba2++OH-==BaSO3↓+H2O |
根据反应:S2O32-+2H+==SO2+S↓+H2O,下表各组实验最快出现浑浊的是
| |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
温度/℃ |
||
| c(mol·L-1) |
V(mL) |
c(mol·L-1) |
V(mL) |
V(mL) |
||
| A |
0.1 |
5 |
0.1 |
5 |
5 |
10 |
| B |
0.2 |
5 |
0.1 |
5 |
10 |
10 |
| C |
0.1 |
5 |
0.1 |
5 |
10 |
30 |
| D |
0.2 |
5 |
0.1 |
5 |
10 |
30 |
西维因是一种高效低毒杀虫剂,在碱性条件下可水解: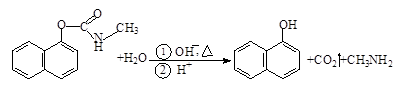
则下列说法正确的是
| A.西维因是一种芳香烃 |
| B.西维因分子中所有碳原子一定共面 |
| C.可用FeCl3溶液检验西维因是否发生水解 |
| D.在Ni催化下1mol西维因最多能与6molH2加成 |
下列说法正确的是
| A.强电解质一定易溶于水 |
| B.钢铁在海水中发生电化腐蚀时,铁是阳极被氧化 |
| C.对可逆反应,升高温度一定存在v(正)>v(逆) |
| D.相同浓度时,强酸中水的电离程度比弱酸的水的电离程度小 |
在0.1mol·L-1的NaHCO3溶液中,下列关系式正确的是
| A.c(Na+)=c(H2CO3) + c(HCO3-)+ c(CO32-) |
| B.c(Na+)> c(CO32-> c(HCO3-)> c(OH-) |
| C.c(Na+)+c(H+)= c(OH-)+ c(HCO3-)+2 c(CO32-) |
| D.c(HCO3-)+ c(CO32-)="0.1" mol·L-1 |
单体液晶(有机物III)是用偶联反应合成的: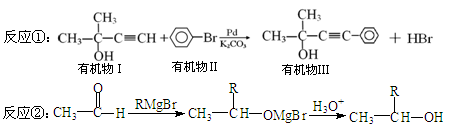
试回答以下问题:
(1)有机物Ⅰ的分子式是 ;有机物Ⅲ不能发生的反应为 :
①取代反应、②加成反应、③消去反应、④醇氧化为醛(或酮)的反应。
(2)以苯为原料生成有机物II的化学方程式为 。
(3)由有机物III制备 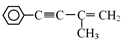 的反应条件是 。
的反应条件是 。
(4)写出有机物III符合下列条件的同分异构体的结构简式 (任写一个):
①苯环上有2个取代基,且环上一氯代物只有2种;
②能发生银镜反应,且醛基连苯环。
(5)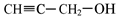 与CH3I能发生类似①的反应,该反应方程式是: 。
与CH3I能发生类似①的反应,该反应方程式是: 。
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g)=CO(g) + 3H2(g) △H=+206.0 kJ·mol-1
II:CO(g)+2H2(g)=CH3OH (g) △H=-129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的△H= 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应器,在一定条件下发生反应I,测得在一定压强下CH4的转化率与温度的关系如图。假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 mol·L-1·min-1。
(3)在某温度和压强下,将一定量 CO与H2充入密闭容器发生反应II生成甲醇,平衡后压缩容器体积至原来的l/2,其他条件不变,对平衡体系产生的影响是 (填序号):
a.c ( H2 )减少;
b.平衡常数K增大;
c.CH3OH 的物质的量增加;
d.正反应速率加快,逆反应速率减慢;
e.重新平衡c ( H2 )/ c (CH3OH )减小。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用下图装置模拟上述过程,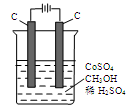
则:
Co2+在阳极的电极反应式为: ;
除去甲醇的离子方程式为 。
氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为 。
(2)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g)ΔH=-a kJ·mol-1 (a>0)
N2O4(g)ΔH=-a kJ·mol-1 (a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题:
①298k时,该反应的平衡常数为 L ·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
a.混合气体的密度保持不变;
b.混合气体的颜色不再变化;
c.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序是 。
铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是 (只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计成铁铜原电池,请图甲中的横线上完成标注。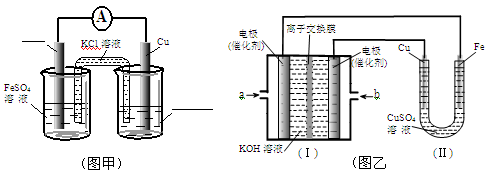
②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入 (填“CH4”或“O2”),b处电极上发生的电极反应式为 ==4OH-;
若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,当阳极产生的气体为448mL(标准状况下)时,溶液的pH= (假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后,直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号