下列四个装置图均与电化学有关,请根据图示回答相关问题:
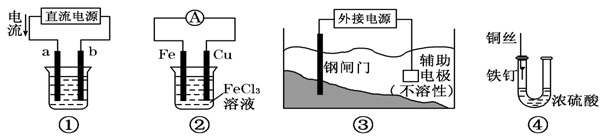
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
下列表述不正确的是
| A |
B |
C |
D |
 |
 |
 |
 |
| 盐桥中的Cl-移向ZnSO4溶液 |
a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 |
粗铜的电极反应式为: Cu2++2e-=Cu |
正极反应式为: O2+4e-+2H2O=4OH- |
下列有关说法正确的是
| A.S(s,单斜)═S(s,正交) ΔH= +0.33kJ•mol‑1,正交硫比单斜硫稳定 |
| B.2H2(g)+O2(g)═2H2O(g); ΔH=﹣489.6kJ•mol-1,氢气的燃烧热为489.6kJ•mol-1 |
| C.当镀锌铁制品的镀层破损时,镀层仍能对铁制品起到保护作用 |
| D.锌锰干电池工作一段时间后碳棒变细 |
关于下列各装置图的叙述中,正确的是
| A.用装置①精炼铜,则b极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的正极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
下列有关金属腐蚀与防护的说法正确的是
| A.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程 |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2===2Fe(OH)2。以下说法正确的是
| A.负极发生的反应为:Fe-2e-===Fe2+ |
| B.正极发生的反应为:2H2O+O2+2e-===4OH- |
| C.原电池是将电能转变为化学能的装置 |
| D.钢柱在水下部分比在水面处更容易腐蚀 |
CuCl2、CuCl是重要的化工原料,广泛地用作有机合成催化剂。实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如下:

请回答下列问题:
(1)如图装置进行反应①,导管a通入氯气
(夹持仪器和加热装置省略)。观察到的现象是 ,
写出铜与氯气反应的化学方程式 。
(2)上述流程中固体K溶于稀盐酸的目的是 。
试剂X、固体J的物质最好分别为 。
a.NaOH Fe(OH)3 b.NH3·H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式 。

(4)反应后,如图盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该红褐色沉淀的主要化学式是 。该腐蚀过程的正极反应式为 。
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式 。
某小组为研究金属的腐蚀与防护,设计如图所示装置。下列叙述不正确的是( )
| A.若X为碳棒,为减缓铁的腐蚀,开关K应置于N处 |
| B.若X为碳棒,开关K置于M处,会加快铁的腐蚀 |
| C.若X为锌,开关K置于M处,就是牺牲阳极的阴极保护法 |
| D.若X为锌,开关K置于N处,铁电极发生的反应为Fe-2e-=Fe3+ |
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是
| A.溶液pH≤2时,生铁发生析氢腐蚀 |
| B.在酸性溶液中生铁可能发生吸氧腐蚀 |
| C.析氢腐蚀和吸氧腐蚀的速率一样快 |
| D.两溶液中负极反应均为:Fe﹣2e﹣=Fe2+ |
下列各项操作或现象能达到预期实验目的的是
| 选项 |
操作或现象 |
实验目的 |
| A |
将铁钉放入试管中,用盐酸浸没 |
验证铁的吸氧腐蚀 |
| B |
向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 |
证明Br—还原性强于Cl— |
| C |
将氯化亚铁固体溶于适量蒸馏水中 |
配制FeCl2溶液 |
| D |
将混有氯化氢杂质的氯气通过装有饱和NaHCO3溶液的洗气瓶 |
除去氯气中的HCl气体 |
下列实验过程可以达到实验目的的是( )
| 编号 |
实验目的 |
实验过程 |
| A |
配制 的溶液 |
称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容 |
| B |
探究维生素C的还原性 |
向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
| C |
制取并纯化氢气 |
向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和 溶液 |
| D |
探究浓度对反应速率的影响 |
向2支盛有5mL不同浓度 溶液的试管中同时加入2mL5% 溶液,观察实验现象 |
| A. | A |
B. | B |
C. | C |
D. | D |
下列实验与对应结论正确的是
| |
A |
B |
C |
D |
| 装置 |
 |
 |
 |
 |
| 结论 |
Ag2O/Ag极发生 还原反应 |
能证明非金属性Cl > C > Si |
验证铁发生析氢腐蚀 |
白色沉淀是BaSO3 |
如图所示,水槽中试管内有一枚铁钉,放置数天观察:

(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。
(2)若试管内液面上升,则原溶液是 性,发生 腐蚀,
电极反应:负极: ,正极: 。
(3)若试管内液面下降,则原溶液是 性,发生 腐蚀,
电极反应:负极: ,正极: 。
绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加 溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:________、________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关 和 )(设为装置A)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为 。按下图连接好装置进行实验。
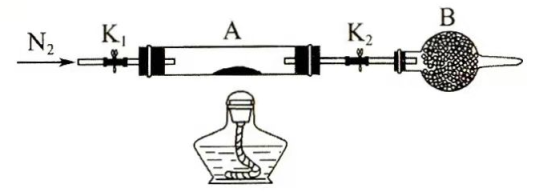
①仪器B的名称是________。
②将下列实验操作步骤正确排序________(填标号);重复上述操作步骤,直至A恒重,记为 。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭 和
d.打开 和 ,缓缓通入
e.称量Af.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目 ________(列式表示)。若实验时按a、d次序操作,则使x________(填"偏大""偏小"或"无影响")。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开 和 ,缓缓通入 ,加热。实验后反应管中残留固体为红色粉末。
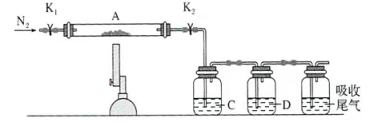
① 中的溶液依次为________(填标号)。 中有气泡冒出,并可观察到的现象分别为________。
a.品红
b.
c.
d.
e.浓
②写出硫酸亚铁高温分解反应的化学方程式________。