装置甲、乙、丙的烧杯中都盛有稀硫酸。
(1)装置丙中的Fe电极上的反应式:____________________。
(2)装置乙中被腐蚀的金属是________________(填元素符号),比较装置甲、乙、丙中纯铁被腐蚀的速率由快到慢的顺序是_____________。
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图丁。请回答:
A电极对应的金属是____________(写元素名称),B电极的电极反应式是______________________。
镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因_____________________。
下列有关金属的说法中,正确的是
①纯铁较生铁不易生锈;②冶炼铝和钠都可以用电解法;③KSCN溶液可以检验Fe3+离子;④缺钙会引起骨质疏松,缺铁会引起贫血;⑤青铜、不锈钢、硬铝都是合金;⑥铜与硫反应,生成黑色的CuS
| A.①②③④⑤ | B.②③④⑤⑥ | C.①③④⑤ | D.①②③④⑤⑥ |
打开下图所示装置中的止水夹,一段时间后,可能观察到的现象是
| A.烧杯中有气泡产生 | B.试管内有黄绿色气体产生 |
| C.铁丝网的表面产生锈迹 | D.烧杯内溶液变红色 |
下列实验过程可以达到实验目的的是( )
| 编号 |
实验目的 |
实验过程 |
| A |
配制 的溶液 |
称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容 |
| B |
探究维生素C的还原性 |
向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
| C |
制取并纯化氢气 |
向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和 溶液 |
| D |
探究浓度对反应速率的影响 |
向2支盛有5mL不同浓度 溶液的试管中同时加入2mL5% 溶液,观察实验现象 |
| A. | A |
B. | B |
C. | C |
D. | D |
化学与生产生活、环境保护密切相关.下列说法中不正确的是
| A.铁表面镀锌可增强其抗腐蚀性 |
| B.漂白粉的有效成分是CaCl2和Ca(ClO)2 |
| C.氢氧化铝是治疗胃酸过多的药物的有效成分之一 |
| D.“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气 |
下列各项操作或现象能达到预期实验目的的是
| 选项 |
操作或现象 |
实验目的 |
| A |
将铁钉放入试管中,用盐酸浸没 |
验证铁的吸氧腐蚀 |
| B |
向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 |
证明Br—还原性强于Cl— |
| C |
将氯化亚铁固体溶于适量蒸馏水中 |
配制FeCl2溶液 |
| D |
将混有氯化氢杂质的氯气通过装有饱和NaHCO3溶液的洗气瓶 |
除去氯气中的HCl气体 |
绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加 溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:________、________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关 和 )(设为装置A)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为 。按下图连接好装置进行实验。
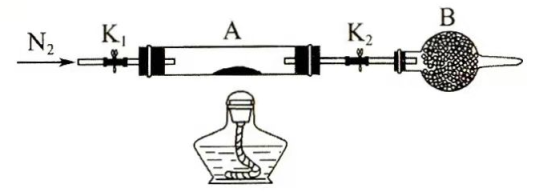
①仪器B的名称是________。
②将下列实验操作步骤正确排序________(填标号);重复上述操作步骤,直至A恒重,记为 。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭 和
d.打开 和 ,缓缓通入
e.称量Af.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目 ________(列式表示)。若实验时按a、d次序操作,则使x________(填"偏大""偏小"或"无影响")。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开 和 ,缓缓通入 ,加热。实验后反应管中残留固体为红色粉末。
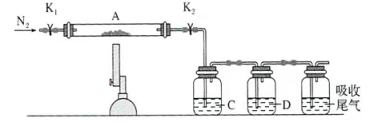
① 中的溶液依次为________(填标号)。 中有气泡冒出,并可观察到的现象分别为________。
a.品红
b.
c.
d.
e.浓
②写出硫酸亚铁高温分解反应的化学方程式________。
下列实验与对应结论正确的是
| |
A |
B |
C |
D |
| 装置 |
 |
 |
 |
 |
| 结论 |
Ag2O/Ag极发生 还原反应 |
能证明非金属性Cl > C > Si |
验证铁发生析氢腐蚀 |
白色沉淀是BaSO3 |
下列叙述不正确的是
| A.金属腐蚀的本质是金属原子失去电子而被氧化 |
| B.钢铁吸氧腐蚀的正极反应是:O2+4e—+2H2O=4OH— |
| C.氢氧燃料电池中,氢气在负极发生氧化反应 |
| D.将地下钢管与直流电源的正极相连,用来保护钢管 |
如图所示,水槽中试管内有一枚铁钉,放置数天观察:

(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。
(2)若试管内液面上升,则原溶液是 性,发生 腐蚀,
电极反应:负极: ,正极: 。
(3)若试管内液面下降,则原溶液是 性,发生 腐蚀,
电极反应:负极: ,正极: 。
铁钉和碳棒用导线连接,浸入稀NaCl溶液中,正极发生的反应是( )
| A.2H++2e-===H2↑ | B.2H2O+O2+4e-===4OH- |
| C.Fe-2e-===Fe2+ | D.4OH--4e-===2H2O+O2↑ |
下列用来表示物质变化的化学用语中,正确的是( )
| A.钢铁发生电化学腐蚀的正极反应式:Fe﹣2e﹣=Fe2+ |
B.HS﹣的水解方程式:HS﹣+H2O S2﹣+H3O+ S2﹣+H3O+ |
C.CO32﹣的水解方程式:CO32﹣+H2O HCO3﹣+OH﹣ HCO3﹣+OH﹣ |
| D.AlCl3溶液与Na2CO3溶液混合:2Al3++3CO32﹣=Al2(CO3)3↓ |
如图所示,水槽中试管内有一枚铁钉,放置数天观察:

(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。
(2)若试管内液面上升,则原溶液是 性,发生 腐蚀,
电极反应:负极: ,正极: 。
(3)若试管内液面下降,则原溶液是 性,发生 腐蚀,
电极反应:负极: ,正极: 。
下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
| A.水中的钢闸门连接电源的负极 | B.金属护栏表面涂漆 |
| C.汽水底盘喷涂高分子膜 | D.地下钢管连接镁块 |