(16分)化学实验有助于理解化学知识,提升科学素养。
I.某探究小组用以下右图装置做如下实验。
| 实验编号 |
a中试剂 |
b中试剂 |
 |
| 1 |
0.1克Na、3 mL水 |
0.1克Na、3 mL乙醇 |
|
| 2 |
3 mL水 |
3 mL饱和FeSO4溶液 |
(1)实验1:同时加入试剂,反应开始阶段可观察到U形管中液面 (填编号,下同),反应结束静置一段时间,最终U形管中液面 。
a.左高右低 b.左低右高 c.左右基本持平
(2)实验2:一段时间后观察到U形管中液面左低右高, b管溶液中出现红褐色浑浊物,请解释出现上述现象的原因: 。
II.某研究小组为探究弱酸性条件下铁的电化学腐蚀类型,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图(1)所示)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(3)请填满表中空格,以完成实验设计:
| 编号 |
实验目的 |
炭粉/g |
铁粉/g |
醋酸浓度/mol/L |
| ① |
作参照实验 |
0.5 |
2.0 |
1.0 |
| ② |
探究醋酸浓度对实验的影响 |
0.5 |
|
0.1 |
| ③ |
|
0.2 |
2.0 |
1.0 |
(4)实验①测得容器中的压强随时间的变化如图(2)所示。该小组得出0~t1时压强增大的主要原因是: 。t2时,容器中压强明显变小的原因是 。请在图(3)中用箭头标出发生该腐蚀时A和B之间的电子移动方向。
【原创】现有A、B、C、D、E五种金属片,①把A、C用导线连接后同时浸入稀硫酸铜溶液中,A上有红色固体产生;②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生氧化反应;③把A、B用导线连接后同时浸入稀硫酸溶液中,电流方向为B→导线→A;④将E放入水中,立即有气体产生。根据上述情况,回答下列问题:
(1)在①中,金属片_______发生氧化反应;
(2)在②中,金属片_______作负极;
(3)如果把B、D用导线连接后同时浸入稀硫酸溶液,则金属片_______上有气泡产生;
(4)上述五种金属的活动性顺序是__________________。
铁、铜及其化合物在工农业生产中应用广泛。
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为 。在含有等浓度硫酸溶液的下列装置中,铁腐蚀的速率由快到慢的顺序是 (用序号填写)。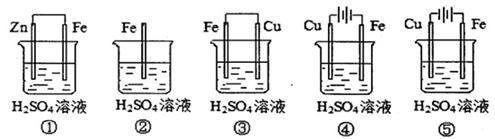
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)  H="-1118" kJ·mol-1
H="-1118" kJ·mol-1
②2Al(s)+3/2O2(g)=A12O3(s)  H="-1675.7" kJ·mol-1
H="-1675.7" kJ·mol-1
则焊接钢轨时铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为 。
(3)Na2FeO4具有强氧化性,其电解制法如图所示,请写出阳极的电极反应式 。Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是 。
(4)工业上常用FeCl3溶液腐蚀印刷线路板,发生反应的离子方程式是 。若腐蚀铜板后的溶液中,Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,结合下图分析,当混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 。从图中数据计算Fe(OH)2的溶度积Ksp[Fe(OH)2]= 。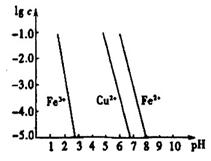
已知:横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度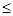 10-5 mol·L-1时,可认为沉淀完全)。
10-5 mol·L-1时,可认为沉淀完全)。
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢材年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为________________
(2)为了降低某铁闸门被腐蚀的速率,可以采用上述图甲所示的方案,其中焊接在铁闸门上的固定材料R可以采用____(填序号)。
| A.铜 | B.钠 | C.锌 | D.石墨 |
(3)上图乙所示的方案也可以降抵铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的_______极。
如图:A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 。Sn极附近溶液的pH值 (填“变大”、“变小”、“不变”)
(3)C中被腐蚀的金属是 ,该电极电极反应式为 ,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为 。
I.下列说法不正确的是 (填字母代码)。
A.对于Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq) Al3++3OH-,前者为溶解平衡,后者为电离平衡 Al3++3OH-,前者为溶解平衡,后者为电离平衡 |
| B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
| C.能源、信息与材料通常被称为现代社会发展的三大支柱 |
| D.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
E.除去硬水中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2溶解度比 MgCO3的小
II.向含有AgI的饱和溶液中:
(1)加入固体AgNO3,则c(I-) (填“变大”、“变小”或“不变”,下同)。
(2)若改加更多的AgI,则c(Ag+) 。
(3)若改加AgCl固体,则c(I-) ,而c(Ag+) 。
III.用“>”、“<”或“=”填空:
(1)25℃时1mol/L FeCl3溶液的pH 80℃时1mol/L FeCl3溶液的pH。
(2)已知NaHSO3溶液中c(HSO3-)>c(SO32-)>c(H2SO3),则溶液中c(H+) c(OH-)。
(3)常温下,取等物质的量浓度的HA溶液与NaOH溶液等体积混合,测得混合溶液的pH=8,混合溶液中由水电离出的c(H+)水 NaOH溶液中由水电离出的c(H+)水。
(1)某兴趣小组利用如图所示装置进行实验。
闭合K1,U形管内除电极上有气泡外,还可观察到的现象是 ;在A注射器收集到的气体是 ,阳极电极反应式为 。当电路中转移0.001mol电子时,B注射器最多可以收集到气体 mL(折算为标准状况)。
(2)某兴趣小组利用如图所示装置进行实验,对钢铁的电化学腐蚀原理进行探究。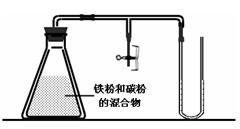
①首先向锥形瓶内加入铁粉和碳粉的混合物、氯化钠溶液,半分钟后发现U型管内左侧液面高过右侧液面,这现象说明,在中性条件下发生 腐蚀,请写出该反应的电极反应方程式
负极: 正极:
②清洗锥形瓶后,重新加入铁粉和碳粉的混合物,加入1mol/L醋酸溶液,半分钟后发现U型管内左侧液面高过右侧液面,这一现象说明,前半分钟 腐蚀占优势,请写出这时正极主要的电极反应方程式 ,5分钟后发现U型管内右侧液面高过左侧液面,此时 腐蚀占据优势,请写出此时正极的电极反应方程式 。
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为 。
②步骤II中发生反应:4Fe(NO3) 2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
写出钢铁生锈的电极反应式(水膜呈中性):
负极___________________________
正极___________________________
24.(15分)本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》
(4分)性能各异的各种材料的广泛应用大大提高了人们的生活水平。回答问题:
(1)家庭中“钢精锅”是由铝合金做成的,在烧菜时能否放大量醋炖煮? 。(填能或否)
(2)下列关于铁制品保护措施的说法中不正确的有 (填序号)。
A.在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油
B.相同条件下,马口铁(表层镀锡)与白铁(表层镀锌)相比,马口铁更为耐用
C.在海轮的外壳上常焊有锌块,且定期更新
D.将不锈钢制成刀具和餐具,有的刀具还进行烤蓝处理
(3)在快中子反应堆中得以广泛应用的钠钾合金,这个事实说明合金的熔点比其成分金属的熔点 (填字母)。
a.高 b.低 c.可能高也可能低
(4)轨道交通建设需要大量金属材料。下列金属材料最容易发生腐蚀的是 (填字母)
a、铝合金 b、钢铁 c、纯度很高的铁
(9分) 观察下列几个装置示意图,有关叙述正确的是
(1)在①图中,发生反应的化学方程式为: 。
(2)在②图中,待镀铁制品应与电源 极相连,电极反应式为: 。
(3)在③图中,外电路电子由 极流向 极,若电解液为KOH溶液,则b极的反应式为 。
某研究性学习小组探究金属锈蚀的条件,进行如下对照实验:
(1)数天后铁钉明显锈蚀的装置是 ;
(2)铁制品锈蚀的条件是 ;
(3)铁钉生锈主要属于 腐蚀(填“化学”或“电化学”);
(4)写出金属防护的一种常用方法 。
铁及其化合物与生产、生活关系密切。
Ⅰ.为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与蓄电池这样的直流电源的 极(填“正”或“负”)相连。
II.为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。

用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号)。
| A.石墨 | B.镁 | C.银 | D.铂 |
(2)实验过程中,SO42− (填“从左向右”“从右向左”或“不”)移动
(3)滤纸上发生的化学方程式为: 。
III.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(4)电解过程中,X极溶液的pH (填“增大”“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为4OH−-4e−=2H2O+O2↑和 。
(6)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为 mL(均已折算为标准状况时气体体积)。
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表中②的实验目的:
| 编号 |
实验目的 |
碳粉/g |
铁粉/g |
醋酸/% |
| ① |
为以下实验作参照 |
0.5 |
2.0 |
90.0 |
| ② |
|
0.5 |
2.0 |
36.0 |
| ③ |
碳粉质量的影响 |
0.2 |
2.0 |
90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了吸氧腐蚀;此时,碳粉表面发生了 (填“氧化”或“还原”)反应,其电极反应式是: 。
(3)该小组对图中0~t1时压强变大的原因提出如下假设。
请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二: ;
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤及结论: 。