铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。

①该电化腐蚀称为。
②图中四个区域,生成铁锈最多的是(填字母)。
(2)用废铁皮制取铁红()的部分流程示意图如下:

①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为。
②步骤Ⅱ中发生反应:,反应产生的
又将废铁皮中的铁转化为
,该反应的化学方程式为。
③上述生产流程中,能体现"绿色化学"思想的是(任写一项)。
(3)已知t℃时,反应的平衡常数
=0.25。
①t℃时,反应达到平衡时=。
②若在1 密闭容器中加入0.02
,并通入
,t℃时反应达到平衡。此时
转化率为50%,则
=。
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 |
实验目的 |
碳粉/ |
铁粉/ |
醋酸/% |
| ① |
为以下实验作参照 |
0.5 |
2.0 |
90.0 |
| ② |
醋酸浓度的影响 |
0.5 |
|
36.0 |
| ③ |
0.2 |
2.0 |
90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。时,容器中压强明显小于起始压强,其原因是铁发生了腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了("氧化"或"还原")反应,其电极反应式是。
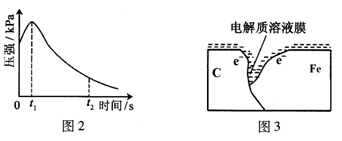
(3)该小组对图2中0~时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
| 实验步骤和结论(不要求写具体操作过程): |
液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
(1)写出羰基硫的电子式 ,羰基硫分子属于 (选填“极性”、“非极性”)分子。
(2)下列能说明碳与硫两元素非金属性相对强弱的是 。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.CS2中碳元素为+4价,硫元素为-2价
(3)羰基硫在水存在时会缓慢水解生成H2S,对钢铁设备产生电化学腐蚀。写出正极的电极反应式 ,负极的反应产物为 (填化学式)。
为除去羰基硫,工业上常采用催化加氢转化法,把羰基硫转化为H2S再除去:COS + H2 CO + H2S
CO + H2S
(4)已知升高温度,会降低羰基硫的转化率。则升高温度,平衡常数K ,反应速率 (均选填“增大”、“减小”、“不变”)。
(5)若反应在恒容绝热密闭容器中进行,能说明该反应已达到平衡状态的是 。
a.容器内气体密度保持不变 b.容器内温度保持不变
c.c(H2)=c(H2S) d.υ(H2)正=υ(H2S)正
(6)已知该反应的平衡常数很大,说明 。
镁、铝、铁是重要的金属,在工业生产中用途广泛。
(1)镁与稀硫酸反应的离子方程式为 ;
(2)铝与氧化铁发生铝热反应的化学方程式为 ;
(3)在潮湿的空气里,钢铁表面有一层水膜,很容易发生电化学腐蚀。其中正极的电极反应式为 ;
(4)铝在空气中具有很好的抗腐蚀性能,铝制品在日常生活中被广泛应用。在海洋工程上,通常用铝合金(Al—Zn—Cd)保护海底钢铁设施,其原理如图18所示:
其中负极发生的电极反应为 ;
在实际应用中,用铝合金而不选用纯铝。纯铝不能很好地起到保护作用,其原因是 。
氯气是工业生产中的重要原料,含氯消毒剂在生活中有着广泛的用途。
(1)工业生产通过电解饱和食盐水获取大量氯气,化学方程式为 。
(2)氯气可用于制取84消毒液(有效成分为NaClO),离子方程式为 。
(3)下列措施能增强84消毒液杀菌能力的是 。
A.加入适量醋酸 B.加入适量亚硫酸 C.加入少量NaOH粉末
(4)氯气与氢氧化钠溶液反应,若所得溶液恰好为中性,则溶液中离子浓度关系正确的是 。
A.c(Na+) + c(H+) = c(OH-) + c(Cl-)
B.c(Na+) = c(ClO-) + c(Cl-)
C.c(Na+) = 2c(ClO-) + c(HClO)
(5)84消毒液不能用于消毒钢铁(含Fe、C)制品,易发生电化学腐蚀,钢铁制品表面生成红褐色沉淀。正极反应为 。