钢铁的生产与使用是人类文明和生活进步的一个重要标志。
(1)工业铝热法炼铁的主要化学反应方程式 。
(2)炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。试回答:①铁锅的腐蚀主要是由 腐蚀造成的。
②铁锅锈蚀的负极反应式为 。
(3)通常使用钢铁是铁和__________的合金;当马口铁(表层镀锡)镀层被损坏后,这时被腐蚀速度比普通铁_______(填“快”或“慢”)。为防止轮船的船体在海水中腐蚀,一般在船身连接 (填“锌块”或“铜块”)
(共8分)中国是世界上最早研究和生产合金的国家之一。合金是被广泛使用的金属材料。
(1)金属腐蚀的现象非常普遍。造成钢铁腐蚀的主要原因是 腐蚀,其负极反应式为 。请例举两种防止铁制品被腐蚀的方法 、 。
(2)钢一般可分为碳素钢和 两大类。根据含碳量的不同,碳素钢可分为 、 和 。
金属是人类生产、生活中不可缺少的重要材料
(1)生铁是 (填化学式)和铁的合金,生铁的硬度比纯铁 (填高、低)。
(2)生铁放置在潮湿的空气发生电化学腐蚀时的正极反应为 ;负极反应为 ;用盐酸可以除去生铁表面的铁锈,该反应的离子方程式为 。
(3)下列对金属制品采取的防护方法不正确的是 (填序号)。
①在电线的外面包上一层塑料层
②在自行车钢圈上镀上一层金属铬
③在海轮的铁制外壳上焊上铜块
④在铁制的暖气片上刷一层油漆
(1)X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸盐溶液中,Y表面有Z析出。其活泼顺序是_________________;
(2)由氢气和氧气反应生成1mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:___________________________ _______。
(3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是 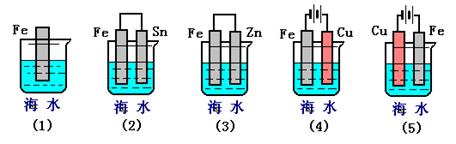
(1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在空气酸度不大的环境中,该原电池的负极是 ,负极反应式为 ;正极是 ,正极反应式为 。
(2)下列装置中,能对Fe片腐蚀起防护作用的有(用序号表示) 
(8分)钢铁很容易生锈而被腐蚀。
(1)钢铁腐蚀主要是吸氧腐蚀,吸氧腐蚀过程中的电极反应为:
负极_______________ _______________;
正极_______________________________ 。
(2)为了降低某水库的铁闸门的腐蚀速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用 _________(填序号)。
| A.铜 | B.钠 | C.锌 | D.石墨 |
(3)图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的___________极上。
(每空2分,共12分)
(Ⅰ)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在空气酸度不大的环境中,其负极是 ,负极反应式为 ;正极是 ,正极反应式为 。受空气的影响还会发生相应的颜色变化,其相应的化学方程式为 。
(Ⅱ)下列各情况,在其中Fe片腐蚀由快到慢的顺序是(用序号表示) 
研究钢铁的腐蚀与防护具有非常重要的意义。
(1)铁的电化学腐蚀包括两种,这两种腐蚀的负极反应均为 ,而正极反应由铁表面的水膜酸碱性决定,当水膜酸度较高时,正极反应式为 ,这种腐蚀称为 腐蚀,而水膜酸性不强时,正极反应式为 ,这种腐蚀称为 腐蚀。
(2)防止钢铁腐蚀的电化学方法有两种,下图中液体为海水,请在图中添加必要的导线、电源,注明另一电极的电极材料名称,使其符合图下所注的保护方法:

I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是 腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:
II.①某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
Cu+H2SO4(稀)=CuSO4+H2↑。
请在答题卡上画出能够实验这一反应的装置图,并在图中进行必要的标注。
②某同学在做一定条件下铜与稀硫酸的反应实验时,看到碳棒上有气泡产生,但铜棒却没有被腐蚀。请你分析其原因:
如图所示,水槽中试管内有一枚铁钉,放置数天观察:
(1)铁钉在逐渐生绣。
(2)若试管内液面上升,发生 腐蚀,电极反应:
负极: ,正极: 。
(3)若试管内液面下降,则原溶液呈 性,发生的电极反应:
正极: 。
(1)下列物质中,与CH2 =CHCH2OH属于同系物的有 ,与CH2 =CHCH2OH互为同分异构体的是 (填序号)
| A.CH3CH2OH | B.CH2 =CH—CH=CH—CH2—OH |
| C.CH3CH=CHCH2OH | D.CH3CH2CHO |
(2)某研究小组对铁生锈进行研究:
经过较长时间后,甲同学观察到的现象是: 上图中的铁钉最容易生锈的是 (填字母),铁锈的主要成分是
②根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为
在由Cu片、Zn片和200 mL稀H2SO4组成的原电池中,当Cu片上放出2.24 L(标准状况下)H2时,H2SO4恰好用完。
(1)此时在导线上有_______ mol电子通过。
(2)Zn片溶解的质量是_____________ g。
(3)原稀H2SO4的物质的量浓度是______________ mol/L。
下图所示水槽中试管内有一枚铁钉,放置数天后观察:
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。
(2)若试管内液面上升,则原溶液呈 性,发生 腐蚀,正极反应式为 。
(3)若试管内液面下降,则原溶液呈 性,发生 腐蚀,正极反应式为 。
回答下列问题:
(1)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
或“无法确定”)。
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)=" CO" (g)+ H2O (g) △H1=" +34.0" kJ/mol
甲酸(g)= CO2 (g)+ H2(g) △H2=" —7.0" kJ/mol
则甲酸的分子式为 ,在该条件下,气态CO2和气态H2反应生成气态CO和气态H2O的热化学方程式为 。
(3)如图所示,水槽中试管内有一枚铁钉,放置数天观察:
I若试管内液面上升,则正极反应: 。
II若试管内液面下降,则发生 腐蚀。
III若溶液甲为水,溶液乙为海水,则铁钉在 (填“甲”或“乙”)溶液中腐蚀的速度快。
I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是 腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:  。
。
II.(1)某同学运用所学知识,自选材料设计实验,实现了在通常条件下不能发生的反应:Cu+H2 S
S O4(稀)=CuSO4+H2↑。请你在右边方
O4(稀)=CuSO4+H2↑。请你在右边方 框内画出能够实现这一反应的装置图。
框内画出能够实现这一反应的装置图。
(2)某同学在做一定条件下铜与稀硫酸的反应实验时,
看到碳棒上有气泡产生,但铜棒却没有被腐蚀。请你分析
其原因: 。