一定条件下,某含碳钢腐蚀情况与溶液pH的关系如下表。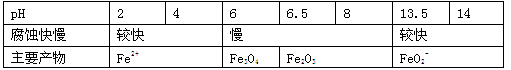
下列说法错误的是
| A.当pH<4时,碳钢主要发生析氢腐蚀 |
| B.当pH>6时,碳钢主要发生吸氧腐蚀 |
| C.当pH>14时,正极反应为O2 + 4H+ + 4e- =2H2O |
| D.将碱性溶液煮沸除去氧气后,碳钢腐蚀的速率会减缓 |
把a、b、c、d 4块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时, d上产生大量气泡;a、c相连时,电流由c经导线流向a;b、d相连时,电子由d经导线流向b,则此4种金属的活动性由强到弱的顺序为
| A.a>b>c>d | B.a>c>d>b | C.c>a>b>d | D.b>a>c>d |
下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度 |
利用如图所示装置进行下列实验,下表中对应叙述正确的是
| A |
X为硫酸氢钠,Y为石墨 K与M连接时;K与N连接时 |
一段时间后溶液的pH均增大 |
| B |
X为氯化钠,Y为石墨 K与M连接时; K与N连接时 |
石墨电极反应均为: 4OH--4e-===2H2O+O2↑ |
| C |
X为硫酸氢钠,Y为锌 K与M连接时; K与N连接时 |
铁电极反应均为: 2H++2e-===H2↑ |
| D |
X为氯化钠,Y为锌 K与M连接时; K与N连接时 |
铁电极的保护方法均为: 牺牲阳极的阴极保护法 |
在城市中地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起后者的腐蚀。原理简化如图所示。则下列有关说法不正确的是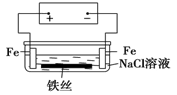
| A.原理图可理解为两个串联电解装置 |
| B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色 |
| C.溶液中铁丝左端电极反应式为:Fe-2e-=Fe2+ |
| D.地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等) |
在城市中地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起后者的腐蚀。原理简化如图所示。则下列有关说法不正确的是
| A.原理图可理解为两个串联电解装置 |
| B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色 |
| C.溶液中铁丝左端电极反应式为:Fe-2e-=Fe2+ |
| D.地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等) |
用图示的方法可以保护钢质闸门。下列说法正确的是
| A.当a、b间用导体连接时,则X应发生氧化反应 |
| B.当a、b间用导体连接时,则X可以是锌或石墨 |
| C.当a、b与外接电源相连时,a应连接电源的正极 |
| D.当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e→Cl2↑ |
下列叙述中, 正确的是
①纯铁比碳素钢易生锈
②大量燃烧含硫燃料是形成酸雨的主要原因
③硅是光导纤维和制造太阳能电池的主要原料
④可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性Cl>C>Si
⑤氯水和过氧化钠都具有漂白作用,其漂白原理相似
⑥用氢氟酸雕刻玻璃是利用氢氟酸能与二氧化硅反应的性质
⑦日本福岛核电站泄露的放射性核素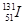 和
和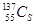 ,前者比后者少8个中子
,前者比后者少8个中子
⑧Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼铝金属
| A.①⑤⑥⑦ | B.②③⑤⑦ | C.③④⑤⑥ | D.②⑤⑥⑧ |
有A、B、C、D四块金属片,进行如下实验,
①A、B用导线相连后,同时插入稀H2SO4中,A极为负极
②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D
③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡
④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,
则四种金属的活动性顺序为
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
如下图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动)。下列叙述正确的是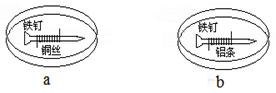
| A.a中铁钉附近呈现红色 |
| B.b中铁钉上发生还原反应 |
| C.a中铜丝上发生氧化反应 |
| D.b中铝条附近有气泡产生 |
下列有关电化学原理的说法中,错误的是
| A.在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 |
| B.在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极 |
| C.氯碱工业,主要依托电解熔融的氯化钠来制取工业上重要的化工原料烧碱和氯气 |
| D.可充电的电池称“二次电池”,在充电时,是将电能转变成化学能,在放电时,又将化学能转化成电能 |
下列说法正确的是
| A.用上图所示方法可保护钢闸门不被腐蚀 |
| B.SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 |
C.常温下,NH4Cl溶液加水稀释, 增大 增大 |
D.C(s)+H2O(g) CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 |
下列说法正确的是
| A.用上图所示方法可保护钢闸门不被腐蚀 |
| B.SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 |
C.常温下,NH4Cl溶液加水稀释,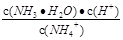 增大 增大 |
D.C(s)+H2O(g) CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 |
下列用来表示物质变化的化学用语中,正确的是
| A.钢铁发生电化学腐蚀的正极反应式:Fe-2e-= Fe2+ |
B.HS-水解的离子方程式:HS-+H2O S2-+H3O+ S2-+H3O+ |
C.CO32-水解的离子方程式:CO32-+2 H2O H2CO3 +2OH- H2CO3 +2OH- |
| D.用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq) |
【原创】铁闸在海水中易被锈蚀,下图原理模型: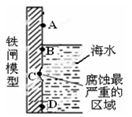
下列说法错误的是
| A.生成铁锈最多的是B点 |
| B.C处腐蚀时的电极反应为Fe-2e-=Fe2+ |
| C.以锌为负极,采用牺牲阳极法防止铁闸的腐蚀,可将锌放在C处。 |
| D.生锈最多的位置为腐蚀最严重的区域 |