下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源的负极 | B.金属护拦表面涂漆 |
| C.汽车底盘喷涂高分子膜 | D.地下钢管连接镁块 |
关于金属的腐蚀与防护,下列叙述正确的是
| A.金属腐蚀就是金属失去电子被还原的过程 |
| B.将需防腐的金属与外加直流电源的负极相连,正极与废铁相连 |
| C.镀锌铁皮发生腐蚀时,正极的电极反应式为:Fe-2e→ Fe2+ |
| D.铁钉在潮湿空气中生锈,是因为直接发生反应:4Fe+3O2→2Fe2O3 |
“暖宝宝”取暖片的材料中含有铁粉、水、硅石、食盐、等,它们组成一个原电池,在反应时释放出热量,铁粉在原电池中充当
| A.负极 | B.正极 | C.阴极 | D.阳极 |
以下现象与电化腐蚀无关的是
| A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B.生铁比软铁芯(几乎是纯铁)容易生锈 |
| C.铁质器件附有铜质配件,在接触处易生铁锈 |
| D.银质奖牌久置后表面变暗 |
在下图各烧杯中盛有海水,铁在其中腐蚀速率由快到慢的顺序是
| A.①>②>③>④>⑤ | B.⑤>④>③>②>① |
| C.④>②>①>③>⑤ | D.②>③>⑤>①>④ |
由下列实验及现象不能推出相应结论的是( )
| |
实验 |
现象 |
结论 |
| A. |
向 的 溶液中加足量铁粉,振荡,加1滴KSCN溶液 |
黄色逐渐消失,加KSCN溶液颜色不变 |
还原性: |
| B. |
将金属钠在燃烧匙中点燃,迅速伸入集满 的集气瓶 |
集气瓶中产生大量白烟,瓶内有黑色颗粒产生 |
具有氧化性 |
| C. |
加热盛有少量 固体的试管,并在试管口放置湿润的红色石蕊试纸 |
石蕊试纸变蓝 |
显碱性 |
| D. |
向2支盛有 相同浓度银氨溶液的试管中分别加入2滴相同浓度的 和 溶液 |
一只试管中产生黄色沉淀,另一支中无明显现象 |
|
下列实验操作规范且能达到目的的是( )
| |
目的 |
操作 |
| A. |
取 盐酸 |
在 酸式滴定管中装入盐酸,调整初始读数为 后,将剩余盐酸放入锥形瓶 |
| B. |
清洗碘升华实验所用试管 |
先用酒精清洗,再用水清洗 |
| C. |
测定醋酸钠溶液 |
用玻璃棒蘸取溶液,点在湿润的 试纸上 |
| D. |
配制浓度为 的 溶液 |
称取 固体 ,放 容量瓶中,加水溶解并稀释至刻度 |
下列四个装置图均与电化学有关,请根据图示回答相关问题:
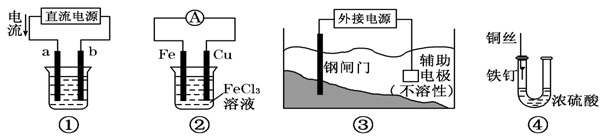
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
关于下列各装置图的叙述中,不正确的是
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应式是Cu+2Fe3+====Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
金属的腐蚀除化学腐蚀和普通的电化学腐蚀外,还有“氧浓差腐蚀”,如在管道或缝隙等处的不同部位氧的浓度不同,在氧浓度低的部位是原电池的负极。下列说法正确的是
| A.纯铁的腐蚀属于电化学腐蚀 |
| B.钢铁吸氧腐蚀时,负极的电极反应式为Fe﹣3e﹣=Fe3﹢ |
| C.海轮在浸水部位镶一些铜锭可起到抗腐蚀作用 |
| D.在图示氧浓差腐蚀中,M极处发生的电极反应为O2+2H2O+4e﹣=4OH﹣ |
下列描述中,不符合生产实际的是
| A.电解熔融的氧化铝制取金属铝,用铁作阳极 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 |
| D.在镀件上电镀锌,用锌作阳极 |
如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片。实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是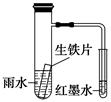
| A.生铁片中的碳是原电池的阳极,发生还原反应 |
| B.雨水酸性较强,生铁片仅发生析氢腐蚀 |
| C.墨水液面回升时,碳电极反应式为O2+2H2O+4e-===4OH- |
| D.具支试管中溶液pH逐渐减小 |
下列说法正确的是
| A.镀锌铁的镀层破损后,镀层仍然对铁起保护作用 |
| B.SiO2不溶于强酸和强碱,可用于制光导纤维 |
| C.C12与SO2使品红溶液褪色的原理相同 |
| D.常温下浓硫酸与铝不反应,可用铝槽车运输 |