下列说法正确的是
| A.放热反应的反应速率一定大于吸热反应的反应速率 |
| B.熔融状态下能导电的化合物一定含离子键 |
| C.增大反应物浓度可加快反应速率,因此可用浓硫酸与铁反应增大生成氢气的速率 |
| D.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 |
下列叙述正确的是
| A.电镀时,通常把待镀的金属制品作阳极 |
| B.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2 |
C.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为:O2+4H++4e—=2H2O |
| D.上图中电子由Zn极流向Cu,盐桥中的Cl—移向CuSO4溶液 |
合理使用材料,改善人类生活。
① 钢铁是人类生产和生活中非常重要的材料,但每年因锈蚀而损失的数量十分惊人。金属腐蚀分为化学腐蚀和电化学腐蚀,两者的微观本质都是发生 的过程。为防止轮船船体在海水中被腐蚀,一般在船身连接 (选填“锌块”或“铜块”)。
② 在普通玻璃制造过程中,碳酸钙与二氧化硅在高温下发生反应的化学方程式是
。橡胶是制造轮胎的重要原料,天然橡胶通过硫化措施,使它的分子转化为 结构,从而增大橡胶的强度。
世博会上澳大利亚馆的外墙采用的是特殊的耐风化钢覆层材料,外墙的颜色每天都在发生着变化,它会随空气中太阳、风雨、湿度的影响,逐渐结出一层锈斑,从橙色到赭红色的转变,看上去外观的生锈程度在增加,运用了钢材生锈原理。下列有关钢材生锈的说法正确的是:
| A.红色铁锈的主要成分是Fe(OH)3 |
| B.钢材在空气中的反应只有氧化、还原及化合反应 |
| C.钢材在空气中的腐蚀主要为电化学腐蚀,其负极的反应为:Fe-3e-=Fe3+ |
| D.空气中太阳、风雨、湿度对钢材的腐蚀有较大影响 |
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是
| A.溶液pH≤2时,生铁发生析氢腐蚀 |
| B.在酸性溶液中生铁可能发生吸氧腐蚀 |
| C.析氢腐蚀和吸氧腐蚀的速率一样快 |
| D.两溶液中负极反应均为:Fe﹣2e﹣=Fe2+ |
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是
| A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 |
| B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小 |
| C.铜极上的反应是2H+ + 2e- ="=" H2↑,O2 + 4e- + 4H+ ="=" 2H2O |
| D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀 |
由下列实验及现象不能推出相应结论的是( )
| |
实验 |
现象 |
结论 |
| A. |
向 的 溶液中加足量铁粉,振荡,加1滴KSCN溶液 |
黄色逐渐消失,加KSCN溶液颜色不变 |
还原性: |
| B. |
将金属钠在燃烧匙中点燃,迅速伸入集满 的集气瓶 |
集气瓶中产生大量白烟,瓶内有黑色颗粒产生 |
具有氧化性 |
| C. |
加热盛有少量 固体的试管,并在试管口放置湿润的红色石蕊试纸 |
石蕊试纸变蓝 |
显碱性 |
| D. |
向2支盛有 相同浓度银氨溶液的试管中分别加入2滴相同浓度的 和 溶液 |
一只试管中产生黄色沉淀,另一支中无明显现象 |
|
下列实验操作规范且能达到目的的是( )
| |
目的 |
操作 |
| A. |
取 盐酸 |
在 酸式滴定管中装入盐酸,调整初始读数为 后,将剩余盐酸放入锥形瓶 |
| B. |
清洗碘升华实验所用试管 |
先用酒精清洗,再用水清洗 |
| C. |
测定醋酸钠溶液 |
用玻璃棒蘸取溶液,点在湿润的 试纸上 |
| D. |
配制浓度为 的 溶液 |
称取 固体 ,放 容量瓶中,加水溶解并稀释至刻度 |
下列四个装置图均与电化学有关,请根据图示回答相关问题:
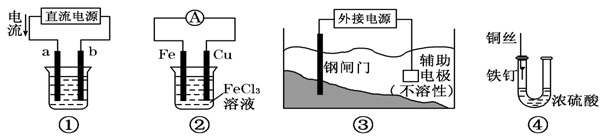
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
关于下列各装置图的叙述中,不正确的是
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应式是Cu+2Fe3+====Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
金属的腐蚀除化学腐蚀和普通的电化学腐蚀外,还有“氧浓差腐蚀”,如在管道或缝隙等处的不同部位氧的浓度不同,在氧浓度低的部位是原电池的负极。下列说法正确的是
| A.纯铁的腐蚀属于电化学腐蚀 |
| B.钢铁吸氧腐蚀时,负极的电极反应式为Fe﹣3e﹣=Fe3﹢ |
| C.海轮在浸水部位镶一些铜锭可起到抗腐蚀作用 |
| D.在图示氧浓差腐蚀中,M极处发生的电极反应为O2+2H2O+4e﹣=4OH﹣ |
下列描述中,不符合生产实际的是
| A.电解熔融的氧化铝制取金属铝,用铁作阳极 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 |
| D.在镀件上电镀锌,用锌作阳极 |
如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片。实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是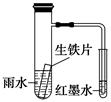
| A.生铁片中的碳是原电池的阳极,发生还原反应 |
| B.雨水酸性较强,生铁片仅发生析氢腐蚀 |
| C.墨水液面回升时,碳电极反应式为O2+2H2O+4e-===4OH- |
| D.具支试管中溶液pH逐渐减小 |
下列说法正确的是
| A.镀锌铁的镀层破损后,镀层仍然对铁起保护作用 |
| B.SiO2不溶于强酸和强碱,可用于制光导纤维 |
| C.C12与SO2使品红溶液褪色的原理相同 |
| D.常温下浓硫酸与铝不反应,可用铝槽车运输 |