[福建]2014届福建省莆田市高三3月质量检测化学试卷
下表中的污染与其来源不对应的是
| |
A |
B |
C |
D |
| 污染 |
白色污染 |
PM2.5 |
氮氧化物 |
水体富营养化 |
| 来源 |
废弃塑料 |
化石燃料燃烧 |
汽车尾气 |
石油化工废弃物 |
下列化学用语或模型表示不正确的是
A.中子数为14的硅原子: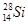 |
B.CH4分子的比例模型: |
C.聚乙烯的结构简式: |
| D.次氯酸分子的结构式:H—O-Cl |
下列关于有机物的说法正确的是
| A.聚丙烯能使酸性高锰酸钾溶液褪色 |
| B.分馏石油得到的各馏分都是纯净物 |
| C.蛋白质水解和油脂皂化都是高分子转化成小分子的过程 |
| D.C4H10有2种同分异构体 |
NA表示阿伏加德罗常数,下列叙述正确的是
| A.1molC2H6中共价键数为8NA |
| B.3.2 g O2和O 3的混合气中氧原子数为0.2NA |
| C.1L 0.1mol·L-1Al2(SO4)3溶液中Al3+数为0.2NA |
| D.标准状况下,22.4 L甲醇的分子数为NA |
下列说法正确的是
| A.镀锌铁的镀层破损后,镀层仍然对铁起保护作用 |
| B.SiO2不溶于强酸和强碱,可用于制光导纤维 |
| C.C12与SO2使品红溶液褪色的原理相同 |
| D.常温下浓硫酸与铝不反应,可用铝槽车运输 |
下列反应的离子方程式正确的是
A.工业上用电解法制备烧碱:2Cl一+H2O 2OH一+H2↑+Cl2↑ 2OH一+H2↑+Cl2↑ |
| B.用食醋除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2 O+ CO2↑ |
C.NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH- H2O+NH3↑ H2O+NH3↑ |
| D.铜溶于硫酸酸化的过氧化氢溶液:Cu+2H++H2O2=Cu2++2H2 O |
根据下图判断,下列说法不正确的是
| A.(C6H10O5)n可表示淀粉或纤维素 |
B.反应②化学方程式为C6H12O6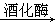 2C2H5OH+2CO2↑ 2C2H5OH+2CO2↑ |
| C.反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去 |
| D.反应③和④都属于取代反应 |
甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如下图(反应条件及其它产物已略去)。
下列说法不正确的是
| A.若甲是AlCl3溶液,则丁可能是NaOH溶液 |
| B.若甲是Fe,则丁可能是Cl2 |
| C.若丁是CO2,则甲可能为Mg |
| D.若丁是O2,则乙、丙的相对分子质量可能相差16 |
下列有关实验的叙述正确的是
| A.滴定实验时,锥形瓶用蒸馏水洗净后,直接盛待测液 |
| B.用100 mL量筒配制100 mL 0.100 0 mol·L-1 Na2CO3溶液 |
| C.用铂丝蘸取少量某溶液进行焰色反应,若火焰呈黄色,则原溶液含有钠盐 |
| D.某溶液加入盐酸酸化的BaCl2溶液,若有白色沉淀生成,则原溶液含有SO42- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.c(H+)=1.0×10-12mol·L-1的溶液:K+、Mg2+、CH3COO一、Br— |
| B.甲基橙呈红色的溶液:NH4+、Ba2+、NO3一、Cl一 |
| C.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
| D.含1.0 mol·L-1 KNO3的溶液:Cl-、SO42-、H+、Fe2+ |
用下列有关实验装置进行相应实验,能达到实验目的的是
| A.用图1装置蒸干CuCl2饱和溶液制备CuCl2晶体 |
| B.用图2装置制取二氧化碳气体 |
| C.用图3装置蒸馏海水制取少量淡水 |
| D.用图4装置分离乙醇与乙酸乙酯的混合物 |
已知:①Na3N+3H2O=3NaOH+NH3↑,②NaH+H2O=NaOH+H2↑。下列叙述正确的是
| A.离子半径:Na+>N3->H+ |
| B.反应①和②都是氧化还原反应 |
| C.反应②每生成1 mol H2,转移的电子数为NA |
| D.Na3N和NaH与盐酸反应都只生成一种盐 |
常温下,有关下列4种溶液的说法正确的是
| ① |
② |
③ |
④ |
| 0.1 mol·L-1氨水 |
pH=11氨水 |
0.1 mol·L-1盐酸 |
pH=3盐酸 |
A.由水电离出的c(H+):③>①
B.①稀释到原来的100倍,pH与②相同
C.①与③混合,若溶液pH=7,则溶液中c(NH4+)>c(Cl-)
D.②与④等体积混合,混合液pH>7
25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是
| A.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出 |
| B.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大 |
C.BaSO4和BaCO3共存的悬浊液中, = =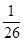 |
| D.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3 |
室温下,用0.100 0 mol·L-1NaOH溶液分别滴定体积均为20.00 mL的盐酸和醋酸溶液,滴定曲线如右图。下列说法正确的是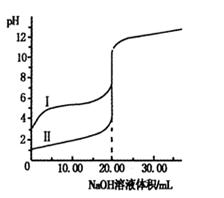
| A.I、Ⅱ分别表示盐酸和醋酸的滴定曲线 |
| B.盐酸和醋酸的浓度均为0.100 0 mol·L-1 |
| C.pH=7时,两种酸所消耗NaOH溶液的体积相等 |
| D.V(NaOH)=20.00mL时,c(Cl一)=c(CH3COO一) |
I.X、W、Y、Z均为短周期主族元素,原子序数依次增大,X原子的最外层电子数是W的4倍,X、Y在周期表中相对位置如下图。
| X |
|
|
| |
|
Y |
(1)X在周期表中的位置是________。
(2)Z单质与石灰乳反应的化学方程式为________。
(3)Y的气态氢化物通入FeCl3溶液中,有Y单质析出,该反应的离子方程式为___。
(4)W-Y高能电池是一种新型电池,它以熔融的W、Y单质为两极,两极之间通过固体电解质传递W+离子。电池反应为:16W(l)+nY8(l) 8W2Yn(l)。放电时,W+离子向___极移动;正极的电极反应式为________。
8W2Yn(l)。放电时,W+离子向___极移动;正极的电极反应式为________。
II.在容积可变的密闭容器中充入A、B、C三种气体,发生反应:x A+yB zC,恒温下,通过压缩容器体积改变压强,分别测得A的平衡浓度如下表:
zC,恒温下,通过压缩容器体积改变压强,分别测得A的平衡浓度如下表: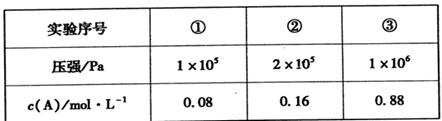
(5)根据①②数据分析得出:x+y ___z(填“>”、“<”或“=”)。
(6)该温度下,当压强为1×106 Pa时,此反应的平衡常数表达式为________。
(13分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途。
(1)在定向爆破中,常利用氧化铁与铝反应放出的热量来切割钢筋,该反应的化学方程式为__。
(2)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) △H=+468.2 kJ·mol-1
C(s)+O2(g)=CO2(g) △H="-393.5" kJ·mol-1。
则Fe(s)与O2 (g)反应生成Fe2 O3 (s)的热化学方程式为______________________。
(3)可用KMnO4溶液滴定Fe2+的浓度,反应的离子方程式如下:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①KMnO4溶液应盛放在_____滴定管中;
②判断达到滴定终点的现象是_____;
③用硫酸酸化的0.020 00 mol·L-1。KMnO4溶液滴定某FeSO4溶液至终点,实验数据记录如下表:
请分析数据并计算,该FeSO4溶液的物质的量浓度为_____。
(4)新型纳米材料ZnFe2Ox,可用于除去工业废气中的某些氧化物。制取新材料和除去废气的转化关系如下图:
①已知ZnFe2O4与H2反应的物质的量之比为2:1,则ZnFe2Ox中x=_____;
②用ZnFe2Ox除去SO2的过程中,氧化剂是_____。
高铁酸钾(K2FeO4)具有很强的氧化性,在生产、生活中有广泛应用。
(1)K2FeO4常用做高效水处理剂,其两种作用分别是_____。
[已知:FeO42-+3e-+4H2O Fe(OH)3+5OH-]
Fe(OH)3+5OH-]
(2)制备K2FeO4可以采用湿式氧化法,流程如下图: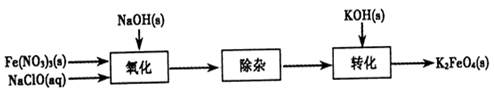
①完成氧化工序的离子方程式: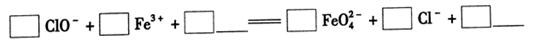
②除杂工序目的是除去Na2FeO4溶液中的杂质,除去的杂质主要有_____(写化学式)。
③转化工序控制在某温度下进行,则该温度下溶解度:Na2FeO4_____K2FeO4 (填“>”、“<”或“=”)。
(3)实验室模拟工业电解法制取K2FeO4,装置如右图。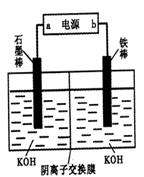
①此装置中电源的负极是____(填“a”或“b”)。
②阳极的电极反应式为______。
(4)已知K2FeO4稀溶液中存在如下平衡:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示:
4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示: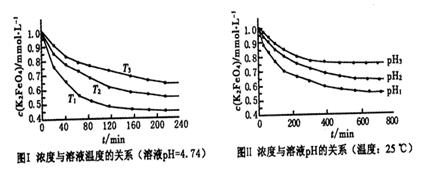
①由图I可得出的结论:该反应的△H___0(填“>”、“<”或“=”)。
②图Ⅱ中pH1___pH3(填“>”、“<”或“=”)。
氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有趾Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)上图C装置中球形干燥管的作用是______________。
(2)完成以下实验步骤:组装好实验装置,首先____________,再加入实验药品。接下来的实验操作是______________,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见___________。
【方案2】用右图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
(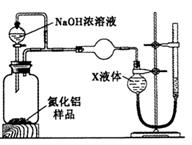
(4)为测定生成气体的体积,量气装置中的X液体可以是_________________________。
a.CCl4 b.H2O c.NH4Cl溶液 d.
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AIN的质量分数__。
【方案3】按以下步骤测定样品中A1N的纯度:
(6)步骤②生成沉淀的离子方程式为___________________。
(7)若在步骤③中未洗涤,测定结果将__________(填“偏高”、“偏低”或“无影响”)。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号