对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
① 碱洗的目的是除去铝材表面的自然氧化膜,为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应为 。取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因是 。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是 。
(3)利用下图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。若X为锌,开关K置于 处。
下图各容器中盛有海水,铁在其中被腐蚀时由快到满的顺序是
| A.③>②>④>① | B.②>①>③>④ |
| C.④>②>③>① | D.④>②>①>③ |
据报道,全球每年发生金属腐蚀而造成的直接经济损失达数千亿美元。下列各电极反应
式中,能表示铁的电化学腐蚀的是
①Fe-2e-=Fe2+
②2H++2e-=H2↑
③Fe-3e-=Fe3+
④2H2O+O2+4e-=4OH-
⑤4OH--4e-=2H2O+O2↑
| A.①②⑤ | B.②③④ | C.①②④ | D.①③⑤ |
下列与金属腐蚀有关的说法正确的是

| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,CuZn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,ZnMnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
能量之间可相互转化:
(1)电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图(见上图),并作相应标注,要求:在同一烧杯中,电极与溶液含相同的金属元素。
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极__________。
③甲乙两种原电池可更有效地将化学能转化为电能的是________,其原因是______________________________。
(2)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(1)的材料中应选__________作阳极。
下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源的负极 |
| B.金属护拦表面涂漆 |
| C.汽车底盘喷涂高分子膜 |
| D.地下钢管连接镁块 |
如下图各烧杯中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
| A.④>②>①>③ | B.②>①>③>④ | C.④>②>③>① | D.③>②>④>① |
下列说法不正确的是
| A.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| B.加热、蒸发MgCl2饱和溶液可得无水MgCl2晶体 |
| C.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 |
| D.室温下,c(NH4+)相等的(NH4)2SO4、NH4HCO3、NH4Cl溶液中:c(NH4)2SO4<c(NH4Cl)<c(NH4HCO3) |
下列叙述中不正确的是:
| A.金属的电化学腐蚀比化学腐蚀普遍 |
| B.钢铁在干燥空气里不易腐蚀 |
| C.用铝质铆钉来接铁板,铁板易被腐蚀 |
| D.金属腐蚀的本质是M-ne-=Mn+而被损耗 |
下列说法不正确的是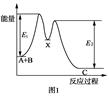
A.NH3·H2O NH4++OH-达到平衡后,升高温度平衡正向移动 NH4++OH-达到平衡后,升高温度平衡正向移动 |
| B.在海轮的外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C.明矾水解生成Al(OH)3胶体,可用作净水剂 |
| D.如图所示的反应过程中A+B→X的△H<0,X→C的△H>0 |
为防止钢铁锈蚀,下列防护方法中正确的是( )
| A.在精密机床的铁床上安装铜螺钉 |
| B.在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中 |
| C.在海轮舷上用铁丝系住锌板浸在海水里 |
| D.在电动输油管的铸铁管上接直流电源的正极 |
下列与金属腐蚀有关的说法,正确的是
| A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图2中,往烧杯中滴加几滴KSCN溶液,溶液变血红色 |
| C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 |
| D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是 
| A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管 |
| B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁 |
| C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑ |
| D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑 |
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
| A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
| B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
| C.电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D.镀锌层破损后即对铁制品失去保护作用 |