下列说法中正确的是 ( )
A. 与 与 均可以水解,故NH4HCO 均可以水解,故NH4HCO 3是弱电解质 3是弱电解质 |
B.25℃时,1LpH=3的盐酸与l LpH=11的氨水 能恰好中和 能恰好中和 |
| C.25℃时,用pH试纸测定出某醋酸溶液的pH=3.5 |
D.25℃时,pH=14的溶液中,Na+、 、K+、ClO-可以大量共存 、K+、ClO-可以大量共存 |
电解质溶液中,阴离子和阳离子均以水合离子存在,如H+可以结合一个H2O形成H3O+,下列物质的电离方程式书写不正确的是( )
| A.CuSO4=Cu2++SO42- | B.Ba(OH)2=Ba2++(OH)22- |
| C.HCl+H2O=H3O++Cl- | D.NaHSO4=Na++HSO4- |
下列关于电解质的说法中,正确的是( )
| A.在水溶液和熔融状态下能导电的化合物 |
| B.饱和食盐水可以导电,所以饱和食盐水属于电解质 |
| C.NH3溶于水形成的溶液能导电,所以NH3是电解质 |
| D.BaSO4在水溶液中难导电,但熔融下能导电,所以.BaSO4是电解质 |
已知H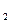 S是弱电解质,把反应方程式:2FeCl
S是弱电解质,把反应方程式:2FeCl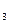 +H
+H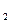 S
S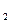 FeCl
FeCl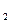 +S↓+2HCl用离子方程式表示,正确的是( )
+S↓+2HCl用离子方程式表示,正确的是( )
A.2Fe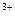 +H +H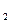 S S 2Fe 2Fe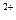 +2H +2H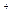 +S↓ +S↓ |
B.Fe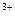 +H +H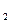 S S Fe Fe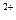 +2H +2H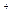 +S↓ +S↓ |
C.2Fe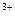 +S +S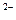  2Fe 2Fe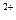 +S↓ +S↓ |
D.2Fe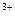 +2Cl +2Cl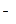 +S +S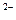 +2H +2H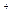  2Fe 2Fe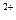 +S↓+2HCl +S↓+2HCl |
某溶液中仅含有Na 、Mg
、Mg 、SO
、SO 、Cl
、Cl 四种离子,其中Na
四种离子,其中Na ∶Mg
∶Mg ∶Cl-=4∶5∶8,若设Na
∶Cl-=4∶5∶8,若设Na 为4n个,则SO
为4n个,则SO 的个数为;该溶液可能由(多选)溶于水混合而得到。
的个数为;该溶液可能由(多选)溶于水混合而得到。
A.NaCl、MgCl 、MgSO 、MgSO |
B.Na SO SO 、MgSO 、MgSO 、MgCl 、MgCl |
C.Na SO SO 、NaCl、MgCl 、NaCl、MgCl |
D.NaCl、MgSO |
根据物质所属的类别及同类别物质的性质规律,利用类比的方法类推物质的可能性质是重要的科学方法,而准确判断物质所属的物质类别是这一方法的前提。下列物质属于强电解质的是( )
A.Ba(OH)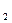 |
B.NH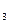 ·H ·H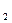 O O |
| C.Cu | D.CH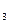 COOH COOH |
电解质电离时一定相等的是
| A.阴、阳离子数 | B.阳离子和阴离子的质量 |
| C.正电荷总数和负电荷总数 | D.每个阳离子和阴离子所带电荷数 |
下列说法正确的是( )
A.因为NaHCO3溶于水后, 不能完全电离成H+和 不能完全电离成H+和 ,所以NaNCO3属于弱电解质 ,所以NaNCO3属于弱电解质 |
| B.弱电解质溶液的导电性一定比强电解质溶液的导电性差 |
| C.浓度相同(即单位体积内含有的分子数相同)的HCl和CH3COOH,前者导电能力比后者强,CH3COOH肯定是弱电解质 |
| D.在熔融状态下不能电离的电解质就是弱电解质 |
【3分】下列各项操作,能发生“先沉淀后溶解”现象的是( )
| A.向饱和Na2CO3溶液中通CO2至过量 |
| B.向Fe(OH)3胶体中逐滴加入稀H2SO4至过量 |
| C.向AgI胶体中逐滴加入稀HCl至过量 |
| D.向Na2SiO3溶液中逐滴加入稀HCl至过量 |