分类法在化学学科发展中起到了非常重要的作用,下列分类依据合理的是
①根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物和两性氧化物等
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否有丁达尔现象分为溶液、胶体和浊液
④根据组成元素的种类将纯净物分为单质和化合物
⑤根据电解质的水溶液导电能力的强弱将电解质分为强电解质和弱电解质
| A.②④⑤ | B.②③④ | C.①③⑤ | D.①②④ |
下列关于电解质的说法正确的是 ( )
| A.液态HCl不导电,所以HCl不是电解质 |
| B.NH3溶于水形成的溶液能导电,所以NH3是电解质 |
| C.Cl2溶于水能导电,所以Cl2是电解质 |
| D.BaSO4在水溶液中难导电,但熔融下能导电所以BaSO4是电解质 |
(16分)“探险队员”——盐酸,不小心走进了化学迷宫,迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。

(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)_____________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有__________个,属于氧化还原反应的有__________个,其中能“吃掉”盐酸的盐是__________(填写物质序号)。
(3)在不能“吃掉”盐酸的物质中,属于非电解质的是________(填写物质序号),在能“吃掉”盐酸的物质中,属于电解质的是 (填写物质序号)。
(4)如果将盐酸换成碳酸镁,它能沿着盐酸走出的路线“走出”这个迷宫吗?填“能”或“不能”_____,写出离子方程式说明其原因: 。
是一种重要的杀菌消毒剂, 也常用来漂白织物等, 其一种生产工艺如下:
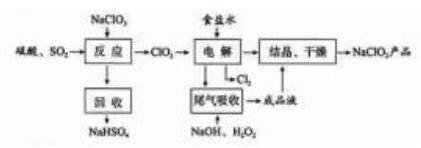
回答下列问题:
(1) 中 的化合价为_ 。
(2) 写出 "反应"步骤中生成 的化学方程式 。
(3) "电解"所用食盐水由粗盐水精制而成, 精制时,为除去 和 , 要加入的试剂分别为 、 。"电解" 中阴极反应的主要产物是_ 。
(4) "尾气吸收"是吸收 "电解"过程排出的少量 。此吸收反应中, 氧化剂与还原剂的
物质的量之比为 ,该反应中氧化产物 。
(5)"有效氯含量"可用来衡量含氯消毒剂的消毒能力, 其定义是:每克含氯消毒剂的氧化
能力相当于多少克 的氧化能力。 的有效氯含量为 。(计算结果保留两位小数)
下列说法正确的是
| A.Cu与石墨都能导电,但都属于非电解质 |
| B.AgCl与BaSO4都是难溶性盐,但都属于强电解质 |
| C.SO2与CaO都是氧化物,因此SO2、CaO都是非电解质 |
| D.NaCl与HCl都是电解质,因此熔融NaCl、液态HCl都能导电 |
(1)下列物质中:①金属铜 固态NaCl ③O2 ④盐酸 ⑤碳棒 ⑥SO2
⑦乙醇⑧熔融KNO3。属于电解质有: ;属于非电解质的有: ;能导电有: 。
(2)写出下列物质在水溶液中的电离方程式
氯化铜 ;硫酸铁
(3)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A 萃取分液 B 加热分解 C 结晶法
D 分液法 E 过滤法 F 蒸馏法
①___________分离饱和食盐水和沙子的混合物。
②___________从硝酸钾和氯化钠的混合溶液中获得硝酸钾。
③___________分离水和酒精。
④___________分离溴水中的溴和水。
下列关于强、弱电解质的叙述中,错误的是
| A.强电解质在溶液中完全电离,不存在电离平衡 |
| B.在溶液里导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |
| C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不同 |
| D.纯的强电解质在液态时,有的导电,有的不导电 |
下列有关叙述正确的是
| A.不需要加热就能发生的反应一定是放热反应 |
| B.弱电解质溶液的导电能力一定比强电解质溶液的弱 |
| C.SO2溶于水,其水溶液能导电,故SO2是电解质 |
| D.升高温度,可提高活化分子百分数,使有效碰撞增多,化学反应速率加快 |
【化学ーー选修2:化学与技术】
高锰酸钾( )是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为 )为原料生产高锰酸钾的工艺路线如下:
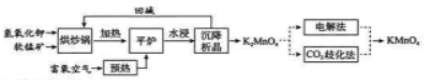
回答下列问题:
(1) 原料软锰矿与氢氧化钾按 的比例在 "烘炒锅"中混配,混配前应将软锰矿粉碎, 其作用是 。
(2) "平炉"中发生的化学方程式为 .
(3)"平炉"中需要加压,其目的是 。
(4) 将 转化为 的生产有两种工艺。
① 歧化法" 是传统工艺, 即在 溶液中通入 气体, 使体系呈中性或弱碱性,
发生歧化反应,反应中生成 和 (写化学式)。
② "电解法" 为现代工艺, 即电解 水溶液, 电解槽中阳极发生的电极反应为 , 阴极逸出的气体是_ 。
③ "电解法" 和 歧化法" 中, 的理论利用率之比为 _ 。
(5)高锰酸钾纯度的测定:称取 样品, 溶解后定容于 容量瓶中, 摇匀。取浓度为 的 标准溶液 , 加入稀硫酸酸化,用 溶液平行滴定三次, 平均消耗的体积为 , 该样品的纯度为 。
(列出计算式即可, 已知 ) 。
化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许 离子通过,氯气的逸出口是 (填标号)。
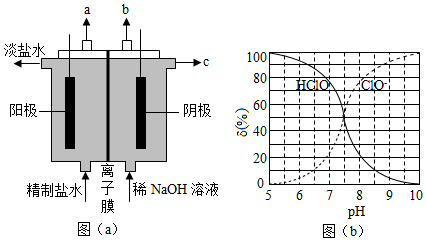
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X) ,X为HClO或ClO ﹣]与pH的关系如图(b)所示。HClO的电离常数K a值为 。
(3)Cl 2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl 2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl 2O的化学方程式为 。
(4)ClO 2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO 2、NaHSO 4、NaHCO 3的"二氧化氯泡腾片",能快速溶于水,溢出大量气泡,得到ClO 2溶液。上述过程中,生成ClO 2的反应属于歧化反应,每生成1mol ClO 2消耗NaClO 2的量为 mol;产生"气泡"的化学方程式为 。
(5)"84消毒液"的有效成分为NaClO,不可与酸性清洁剂混用的原因是 (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为 kg(保留整数)。
下列说法中正确的是
| A.氯化钠水溶液在电流的作用下电离出Na+和Cl- |
| B.二氧化碳的水溶液能够导电,故二氧化碳属于电解质 |
| C.碳酸氢钠在水中电离的离子方程式为NaHCO3=Na++H++CO2- 3 |
| D.碳酸钠属于电解质 |
下列物质能导电的是 ;属于电解质的是 ;属于非电解质的是 (填编号)。
①HCl气体、② NH3、③熔融的NaOH 、④SO2、⑤Cu 、 ⑥氨水 ⑦KNO3溶液 、⑧液态醋酸 、⑨蔗糖、⑩硫酸钡固体
(1)现有下列物质 ①Fe、② HCl气体、③NaOH固体、④NH3气体、⑤ KCl溶液、⑥CH3COOH、⑦SO3、⑧乙醇、⑨BaSO4固体请用以上物质回答下列问题。(填序号)电解质: ;非电解质: ;上述状态能导电的是: 。
(2)按要求写出方程式。
①Mg(OH)2和盐酸: (写出离子方程式)
②足量澄清石灰水通入少量CO2: (写出离子方程式)
③Fe2(SO4)3: (写出电离方程式)
④H++OH—=H2O: (写出对应的化学方程式)
⑤CO32—+2H+=CO2↑+H2O: (写出对应的化学方程式)
下图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号。请回答下列问题:

(1)两种物质都是电解质的是_______(填分类标准代号,下同),两种物质都是氧化物的是________。
(2)分类标准代号A表示______________(多项选择)
a.两物质都是非电解质 b.两物质都是有机物
C.两物质都是含碳化合物 d.两物质都是氧化物
(3)上述五种物质中的某相邻两种物质间能发生反应且有离子反应,写出该反应的离子方程式为: ____________________ _____________________。
(4)用洁净的烧杯取25 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热呈红褐色,得到的分散系称为_____________。