现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体。工艺原理如下图所示。下列说法中不正确的是
| A.左槽中发生的反应是:2Cl--2e-=Cl2↑ |
| B.右槽中的反应式:2H++2 e-=H2↑ |
| C.H+从电解池左槽迁移到右槽 |
| D.FeCl3溶液可以循环利用 |
如图,外接电源为Zn-MnO2干电池,甲、乙为相互串联的两个电解池,请回答:

(1)甲池若为用电解原理精炼铜的装置,
B电极是 极,材料 A电极反应式为 ,
电解质溶液可以是
(2)乙池中Fe极是 极,若滴入少量酚酞试液,开始一段时间后,Fe极附近呈 色,若C电极
材料为石墨,C电极反应式为
(3)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。该电池的负极材料是 ,电极反应式为 。
氯碱工业是以电解饱和食盐水为原理的重要化工生产业。
(1)电解饱和食盐水的化学方程式是
(2)电解时阳极区溶液的pH用盐酸控制在2~3,用化学平衡移动原理解释盐酸的作用 ;
(3)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。某次除杂操作时,往粗盐水中先加入过量的 (填化学式),至沉淀不再产生后,再加入过量的______________(填化学式)和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,解释其原因
[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=5.1×10-9]。
(4)食盐水中若含有NH4+,会在阳极产生难溶于水的NCl3,写出该电极反应式_________________
如下图所示的实验装置,丙为酚酞溶液润湿的淀粉碘化钾试纸,m、n为夹在滤纸两端的铂夹。丁为直流电源,x、y为电源的两极。G为电流计,电极均为石墨电极。闭合K2、断开K1,一段时间后,A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml(都已换算成标况下的体积),回答下列问题:

(1)M溶液可能是 (填序号)。
A.KCl溶液 B.Ba(OH)2溶液 C.KNO3溶液 D.CuCl2溶液
(2)乙池中盛有足量的硫酸铜溶液,D电极上的电极反应式为 ,此时向溶液中加入________克_________可以使溶液完全复原。
(3)滤纸丙上m点附近变为_____色,n点附近变为_____色,
(4)继续电解一段时间后,甲池中A、B极均部分被气体包围,此时闭合K1,断开K2,发现电流计G指针发生偏转,若M为硫酸溶液,写出B电极上发生的反应式__________
如图是一个甲烷燃料电池工作时的示意图。M、N两电极的质量相同,其中一个为银电极一个为铁电极。

(1)写出通入甲烷的铂电极上的电极反应式为__________________________。
(2)若一段时间后M与N两电极的总质量不变,则N电极是 。此时两电极质量差为5.4g,甲池中理论上消耗氧气 mL(标准状况)
(3)若一段时间后M与N两电极的总质量增加4g,N电极质量变化为________克。
铅蓄电池的工作原理为Pb+PbO2+4H++2SO 2PbSO4+2H2O。下图所示装置中,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极,U形管中盛有足量硫酸溶液。先闭合S1足够长时间后断开S1,下列有关说法中不正确的是( )
2PbSO4+2H2O。下图所示装置中,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极,U形管中盛有足量硫酸溶液。先闭合S1足够长时间后断开S1,下列有关说法中不正确的是( )

A.闭合S1时,左侧U形管为原电池,右侧U形管为电解池,F电极上生成氧气
B.若将两U形管中的溶液混合,混合液的质量分数仍为30%
C.若再单独闭合S2,电极A、B的质量会逐渐增加,电极E、F的质量会逐渐减小
D.若再单独闭合S2,E、F电极上发生的反应与之前相同
CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I―==2CuI↓+I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。电解开始不久,阴极区溶液呈红色,而阳极区溶液呈蓝色。下列有关蓝色产生原因的说法正确的是( )
| A.2I―-2e-==I2碘遇淀粉变蓝 |
| B.Cu-2e-==Cu2+ Cu2+ 显蓝色 |
| C.2Cu+4I--4e-==2CuI↓+I2碘遇淀粉变蓝 |
| D.4OH―–4e-==2H2O+O2 O2将I-氧化为I2,碘遇淀粉变蓝 |
以硫酸铜溶液作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼。下列叙述正确的是( )
| A.粗铜与直流电源负极相连 |
| B.相同时间内阳极质量变化与阴极质量变化可能不同 |
| C.硫酸铜溶液浓度始终保持不变 |
| D.杂质Ag以Ag2SO4的形式沉入电解槽形成“阳极泥” |
“8·12”天津港危化仓库爆炸,造成生命、财产的特大损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是 。
A. 水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,可能发生氧化还原反应,下列反应可能发生的是 。
A. NH4NO3 → N2 + O2 + H2O
B. NH4NO3 → NH3 + HNO3
C. NH4NO3 → O2 + HNO3 + H2O
D. NH4NO3→ N2 + HNO3 +H2O
E. NH4NO3→N2+ NH3+ H2O
F. NH4NO3 →N2O + H2O
(3)NaCN属于剧毒物质,有多种无害化处理方法
① H2O2处理法:NaCN + H2O2 —— N2↑+ X + H2O,推测X的化学式为 ,双氧水的电子式为 。
② NaClO处理法:aCN-+bClO-+2cOH-= dCNO-+eN2↑+fCO32-+bCl-+cH2O。 方程式中e : f的值为
(填选项标号)。
A.1 B.1/2 C.2 D.不能确定
③用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无污染的气体,则电解过程中,阳极的电极反应式为 。
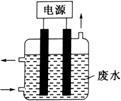
(4)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:_______ _______;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为 。
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生且溶液不变蓝,下列叙述正确的是
| A.铜电极上发生还原反应 |
| B.石墨电极附近溶液呈红色 |
| C.溶液中的Na+向石墨电极移动 |
| D.铜电极附近观察到黄绿色气体 |
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
(1)单质A是一种黄色固体,组成单质A的元素在周期表中的位置是________________。用物理方法洗去试管内壁的A,应选择的试剂是_______________;化学方法洗去试管内壁的A是发生歧化反应生成两种盐,但这两种盐在强酸性条件下不能大量共存,请写出化学方法洗去试管内壁的A时发生的化学反应方程式______________________________。
(2)工业上获得B时常使用电解法,请写出阳极反应的电极反应_________________。
(3)FeCl3溶液中的Fe3+可以催化G与氧气在溶液中的反应,此催化过程分两步进行,请写出Fe3+参与的第一步反应的离子反应方程式_____________________________。
(4)工业上吸收E常用氨水,先生成正盐最终产物为酸式盐。E与该正盐反应的化学方程式___________________________.
(5)将D溶于稀硫酸,向恰好完全反应后所得的溶液中加入过量氢氧化钡溶液,则加入氢氧化钡溶液的过程中的现象是_____________________________。
(6)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为__________,当生成2mol二氧化氯时,转移电子___________mol。
(7)H的溶液与稀硫酸反应的化学方程式______________________________。
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液的pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
| A.用石墨作阳极,铁作阴极 |
| B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O |
| C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH- |
| D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O |
传感器可以检测空气中SO2的含量,传感器工作原理如图所示,下列叙述正确的是
| A.a为电源的负极 |
| B.负极反应方程式为:Ag-e-+Cl-=AgCl |
| C.阴极的电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O |
| D.当电路中转移电子的物质的量为5×10-5 mol时,进入传感器的SO2为1.12 mL |