如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为 (溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)( )

| A.13、7、1 | B.12、7、2 | C.1、7、13 | D.7、13、1 |
若某池(电解池或原电池)的总反应离子方程式是Cu+2H+═Cu2++H2↑,关于此池的有关说法正确的是( )
| A.该池只能是电解池,且金属铜为该电解池的阳极 |
| B.该池只能是原电池,且电解质溶液为硝酸 |
| C.该池可能是原电池,也可能是电解池 |
| D.该池只能是电解池,电解质溶液可以是硫酸铜 |
Ⅰ在右图所示装置中,U形管内装满稀H2SO4,a为铁电极,b为多孔石墨电极。
①断开K2接通K1时,为_____________极,b电极上的电极反应式为________________;
②断开K1时接通K2,a为_____________极;该电极上的电极反应式是____________一段时间后,溶液的pH_________(填“增大”、“减小”或“不变”)
Ⅱ、双隔膜电解池的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气。
a气体为______________,B溶液为________________;C隔膜为____________(阳离子交换膜、阴离子交换膜),该电解反应的总方程式可表示为_______________________。
某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题: 
(1)电源A 极的名称是__________(正极或负极)。
(2)甲装置中的C极的电极反应式______________________________。
(3)欲用丙装置给铜镀银,G应该是______(填“铜”或“银”),电镀液的主要成分是__________(填化学式)。
(4)装置丁中的现象是__________________________。
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )

| A.用石墨作阳极,铁作阴极 |
| B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O |
| C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH- |
| D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O |
Ⅰ、工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质。为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,某温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0KJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示
CH3OH(g)+H2O(g)△H=-49.0KJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示

(1)该反应该温度下,化学平衡常数的值为_______________________
(2)下列说法中能作为反应达到平衡状态标志的是___________________(填字母)。
A.容器内压强不再发生变化
B.平均相对分子质量不再变化
C.c(CO2)和c(H2)之比等于1:3
D.相同时间内每断裂3molH-H键,同时断裂3molO-H键
(3)下列措施中能使n(CH3OH)/n(CO2)减小的是__________________
A.再充入1molCO2和3molH2 B.将H2O(g)从体系中分离
C.充入He(g),使体系压强增大 D.升高温度
Ⅱ、钢铁工业是国家工业的支柱,每年钢铁生锈让国家损失大量资金,请回答钢铁腐蚀与防护过程中的有关问题。
(1)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:

①A电极对应的金属是_________(写元素名称),B电极的电极反应式是__________;
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为__________;
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因___________________________。
(Ⅰ)(1)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程:
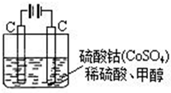
①写出阳极电极反应式____________________________________________.
②写出除去甲醇的离子方程式__________________________________________.
③若右图装置中的电源为甲醇-空气-KOH 溶液的燃料电池,则电池负极的电极反应式:__________________________________________,净化含1mol甲醇的水燃料电池需消耗KOH______mol.
(Ⅱ)化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理如下图所示。
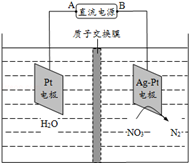
(1)电源正极为 (填A或B),阴极反应式为 。
(2)电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为 g。
某小组用右图装置进行实验,下列说法正确的是( )

| A.盐桥中的电解质可以用KC1 |
| B.闭合K,外电路电流方向为Fe电极→石墨电极 |
| C.闭合K,石墨电极上只生成铜 |
| D.导线中流过0.15 mol e-时,加入5.55 gCu2(OH)2CO3 ,CuSO4溶液可恢复原组成 |
图甲池和乙池中的四个电极都是惰性材料,请根据图示判断下列说法正确的是
| A.两个装置之间没有盐桥,故不能形成电流 |
| B.a电极的电极反应式C2H5OH+16OH--12e-= 2CO+11H2O |
| C.一段时间后,乙池d电极周围的溶液呈现棕褐色 |
| D.乙池在反应前后溶液的pH不变 |
(1)某课外活动小组同学用图1装置(M、N为外电源的两个电极)进行实验,试回答下列问题:
①若开始时开关K与a连接,则铁发生电化学腐蚀中的_________腐蚀。请写出正极反应式:____________。
②若开始时开关K与b连接时,两极均有气体产生,则铁电极为__________极(填“阴”或“阳”),该电极上发生的电极反应式为_____________,总反应的离子方程式为________________。
(2)该小组同学设想,用如图2所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠。
①B出口导出的气体是__________,制得的氢氧化钠溶液从出口____________(填“A”、“B”、“C”或“D”)导出。通过阴离子交换膜的离子数____________(填“>”、“<”或“=”)通过阳离子交换膜的离子数。
②氢气、氧气和氢氧化钠溶液又可制成燃料电池,该电池的负极反应式为__________________。
下列有关说法正确的是( )
| A.锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是Cu2+水解增大了H+浓度 |
| B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| D.镀锌铁镀层破损后锌仍能减缓铁腐蚀,其原理为牺牲阳极的阴极保护法 |
在铜片上镀银时,下列叙述正确的是( )
| A.铜片接电源的正极 |
| B.铜片上发生的反应是:Ag++e-= Ag |
| C.银片上发生的反应是:4OH- - 4e-=O2↑+ 2H2O |
| D.需用硫酸铜溶液为电镀液 |
在相同温度下用惰性电极电解下列物质的水溶液,一段时间后溶液的pH减小的是 ( )
| A.HCl | B.NaOH | C.Na2SO4 | D.CuSO4 |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极。

(1)接通电源,经过一段时间后,测得e电极上收集到气体在标准状况下体积为4.48L,乙中c电极质量增加。据此回答问题:
①电源的N端为 极。
②电极b上发生的电极反应为
③电解前后甲溶液 pH ;乙溶液 pH ;丙溶液 pH 。(填“变大”、“ 变小”或“不变”)
(2)写出乙溶液中的电解反应方程式: 需加入 g (填物质名称)复原。