(16分) 研究发现铜具有独特的杀菌功能, 能较好地抑制病菌的生长。现有工业上由辉铜矿石(主要成分Cu2S)的冶炼铜两种方案:
Ⅰ 火法炼铜在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S= 6Cu+SO2↑
此方案的尾气可以用表中方法处理
| 方法1 |
用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)= S(g)+2CO2(g) ΔH="+8." 0 kJ·mol-1 2H2(g)+SO2(g)= S(g)+2H2O(g) ΔH="+90." 4 kJ·mol-1 |
| 方法2 |
用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸 |
Ⅱ“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强;利用Fe2(SO4)3作氧化剂溶解辉铜矿石,溶液酸性又进一步增强,过滤未溶解完的辉铜矿石,在滤液中加入足量的铁屑,待反应完全后过滤出铜和剩余的铁屑,得溶液Xml(设整个过程中其它杂质不参与反应,不考虑溶液离子水解)。其流程如图:
(1)Ⅱ相对于Ⅰ的优点是______________________________。(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S= 6Cu+SO2↑氧化剂是________
(3)已知CO的燃烧热283. 0 kJ·mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式___________。
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为________________。
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式______________________________
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=________________(可以写表达式)。
2013年12月15日4时搭载长征系列火箭的“玉兔号”顺利驶抵月球表面,实现了五星红旗耀月球的创举。火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4做氧化剂。请回答下列问题:
(1)已知:N2(g) + 2O2(g) ="=" 2NO2(g) ΔH=+67.7kJ·mol-1
N2H4(g) + O2(g)="=" N2(g) + 2H2O(g) ΔH=-534.0kJ·mol-1
2NO2(g)  N2O4(g) ΔH=-52.7kJ·mol-1
N2O4(g) ΔH=-52.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: ;
(2)工业上用次氯酸钠与过量的氨气反应制备肼,该反应的化学方程式为: ;
(3)工业上可以用下列反应原理制备氨气:
2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH=Q kJ·mol-1
4NH3(g)+3O2(g) ΔH=Q kJ·mol-1
①已知该反应的平衡常数K与温度的关系如图,则此反应的 Q 0 (填“>”“<”或“=”)。

②若起始加入氮气和水,15分钟后,反应达到平衡,此时NH3的浓度为0.3mol/L,则用氧气表示的反应速率为 。
③常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, (选填编号).
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.v(N2)/v(O2)=2∶3 |
| C.容器中气体的密度不随时间而变化 |
| D.通入稀有气体能提高反应的速率 |
E.若向容器中继续加入N2,N2的转化率将增大
(4)最近华南理工大提出利用电解法制H2O2并以此处理废氨水,装置如图。

①为不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中
c(NH4+) c(NO3-)(填“>”“<”或“=”);
②Ir—Ru惰性电极有吸附O2作用,该电极的电极反应为 ;
③理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为 。
锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
| 物质 |
Mn(OH)2 |
Co(OH)2 |
Ni(OH)2 |
MnS |
CoS |
NiS |
| Ksp |
2.1×10-13 |
3.0×10-16 |
5.0×10-16 |
1.0×10-11 |
5.0×10-22 |
1.0×10-22 |
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是 。
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③ 。
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是 ,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(4)步骤Ⅲ中,滤渣2的主要成分是 。
(5)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(6)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥ mol·L-1。
硝酸铝是重要的化工原料。
(1)在实验室中,硝酸铝必须与可燃物分开存放,是因为硝酸铝具有 。
A.可燃性 B.氧化性 C.还原性
(2)用Al作电极电解HNO3溶液制取Al(NO3)3,电解反应的离子方程式为 。
(3)查资料得知:当Al(NO3)3溶液pH>3时,铝元素有多种存在形态,如Al3+、[Al(OH)]2+、[Al(OH)2]+等。写出[Al(OH)]2+转化为[Al(OH)2]+的离子方程式 。
(4)用硝酸铝溶液(加入分散剂)制备纳米氧化铝粉体的一种工艺流程如下。
①(CH2)6N4水溶液显碱性。请补充完整下列离子方程式。
②经搅拌Ⅱ,pH下降的原因是 。
③凝胶中含有的硝酸盐是 。
(Ksp[Al(OH)3] =1.3×10-33 ;溶液中离子浓度小于1×10-5 mol·L-1时,可认为这种离子在溶液中不存在)
④煅烧过程主要发生如下转化: 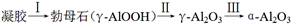 。
。
煅烧过程中样品的失重率(TG%)随温度变化如图。凝胶煅烧失重曲线有明显的三个阶段: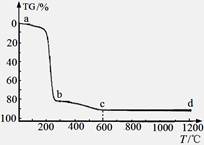
(i)a~b段:失重率82.12%;
(ii)b~c段:失重率9.37%;
(iii)c~d段:失重率几乎为0;
转化Ⅱ对应的失重阶段是 (填序号),转化Ⅲ开始的温度是 。
请仔细观察下列三种装置的构造示意图。根据要求回答问题: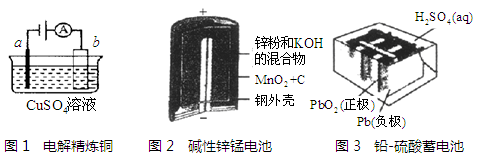
(1)电解精炼铜(如图1)时,b极材料是________(填“纯铜”或“粗铜”);其电解质溶液能否用CuCl2替代?答:________(“能”或“否”)。
(2)碱性锌锰电池(如图2)的总反应式为Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2,该电池的负极反应式为______________________。若有0.65g锌参与了电池反应,则转移电子的物质的量为 mol。
(3)铅-硫酸蓄电池(如图3)放电过程中,负极的电极反应式为 ,充电时,Pb电极应接电源的______极(填“正极”或“负极”)。
(18分)碱金属元素的单质及其化合物被广泛应用于生产、生活中。
②一定量的Na在足量O2中充分燃烧,参加反应的O2体积为5.6 L(标准状况),则该反应过程中转移电子的数目为_________。
(2)金属锂广泛应用于化学电源制造,锂水电池就是其中的一种产品。该电池以金属锂和 钢板为电极材料,以LiOH为电解质,加入水即可放电。
总反应为:2Li+2H2O=2LiOH+H2↑
①锂水电池放电时, 向_________极移动。
向_________极移动。
②写出该电池放电时正极的电极反应式:_________________。
③电解熔融LiCl可以制备金属Li。但LiC1熔点在873 K以上,高温下电解,金属Li产量极低。经过科学家不断研究,发现电解LiCl—KCl的熔盐混合物可以在较低温度下生成金属Li。
你认为,熔盐混合物中KCl的作用是_________________________________________。
写出电解该熔盐混合物过程中阳极的电极反应式:______________________________。
(3)最新研究表明,金属钾可作工业上天然气高温重整的催化剂,有关反应为: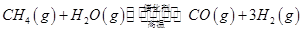 。一定温度下,向2 L容积不变的密闭容器中充入4 mol
。一定温度下,向2 L容积不变的密闭容器中充入4 mol 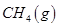 和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。
和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。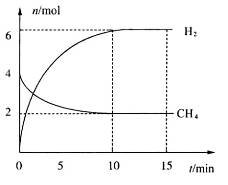
①0~10 min内用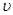 (CO)表示的化学反应速率为_________。
(CO)表示的化学反应速率为_________。
②下列叙述中,能够证明该反应已达到平衡状态的是_________(填序号)。
a.生成3 molH-H键的同时有4 molC-H键断裂
b.其他条件不变时,反应体系的压强保持不变
c.反应混合气体的质量保持不变
d.
③此温度下,该反应的化学平衡常数K=_________mo12·L-2。
目前,全世界的镍消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大的潜力。镍化合物中的三氧化二镍是一种重要的电子元件材料和二次电池材料。工业上可利用含镍合金废料(除镍外,还含有Fe、Cu、Ca、Mg、C等杂质)制取草酸镍,然后高温煅烧草酸镍来制取三氧化二镍。
已知:①草酸的钙、镁、镍盐均难溶于水,且溶解度:NiC2O4> NiC2O4·H2O> NiC2O4·2H2O
②常温下,Ksp[(Fe(OH))3]=4.0×10-38,lg5=0.7
根据下列工艺流程图回答问题: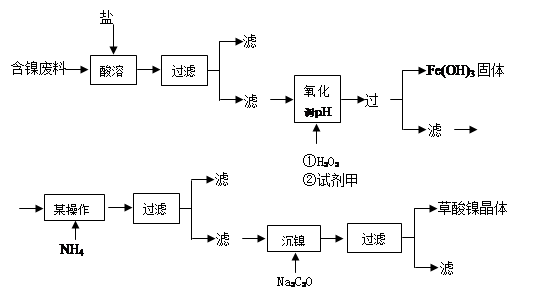
(1)加6%的H2O2时,温度不能太高,其目的是 。若H2O2在一开始酸溶时便与盐酸一起加入,会造成酸溶过滤后的滤液中增加一种金属离子,用离子方程式表示这一情况 。
(2)流程中有一步是调pH,使Fe3+转化为Fe(OH)3沉淀,常温下当溶液中c (Fe3+)=0.5×10-5mol/L时,溶液的pH= 。
(3)流程中加入NH4F的目的是 。
(4)将最后所得的草酸镍晶体在空气中强热到400℃,可生成三氧化二镍和无毒气体,写出该反应的化学方程式 。
(5)工业上还可用电解法制取三氧化二镍,用NaOH溶液调节NiCl2溶液的pH至7.5,再加入适量Na2SO4进行电解,电解产生的Cl2其80%的可将二价镍氧化为三价镍。写出Cl2氧化Ni(OH)2生成三氧化二镍的离子方程式 ;将amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是 。
(6)近年来镍氢电池发展很快,它可由NiO(OH)跟LaNi5H6(LaNi5H6中各元素化合价均可看作是零)组成:6NiO(OH)+LaNi5H6 LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
银铜合金广泛应用于航空工业。从切割废料中回收银并制备铜的化工产品工艺如下:
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)完成煅烧过程中一个反应的化学方程式:
CuO + Al2O3 Cu AlO2 + ↑
Cu AlO2 + ↑
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为______mol CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是 、 、过滤、洗涤和干燥。
含碳化合物在国民经济中占有重要地位。含碳化合物的性质、制备等一直是中学化学研究的焦点。
研究情境一:工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯 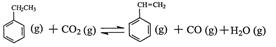 △H=-166kJ·mol-1,平衡常数K
△H=-166kJ·mol-1,平衡常数K
其中乙苯在CO2气氛中的反应可分两步进行。
第一步: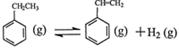 ΔH1,平衡常数K1
ΔH1,平衡常数K1
第二步:H2(g) +CO2(g) CO(g) + H2O(g) ΔH2=-41kJ·mol-1,平衡常数K2
CO(g) + H2O(g) ΔH2=-41kJ·mol-1,平衡常数K2
(1)上述第一步反应的ΔH1=____________,K、K1、K2之间的关系是________________。
(2)某化学研究性学习小组模拟工业用乙苯与CO2脱氢生产苯乙烯。在3L固定容积密闭容器内,乙苯与CO2的反应在I、II、III三种不同的条件下进行实验。乙苯、CO2的起始浓度分别为1.0mol·L-1和3.0mol·L-1,其中实验I在T1°C,0.3MPa,而实验II、III分别改变了实验其他条件。乙苯的浓度随时间的变化如图所示。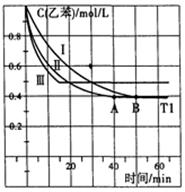
①实验I 苯乙烯在0—50min的平均反应速率是____________。
②实验III改变的条件可能是_______________________________________________。
③对于实验I,下列叙述能说明乙苯与CO2反应达到平衡的是_______。
a.平衡常数K不再增大 b.CO2的转化率不再增大
c.混合气体的平均相对分子质量不再改变 d.反应物不再转化为生成物
研究情境二:2013年12月14日21时11分,嫦娥三号探测器在月球表面预选着陆区域成功着陆,标志我国已成为世界上第三个实现地外天体软着陆的国家。
(3)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液。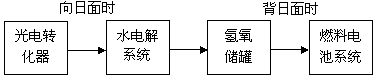
如果某段时间内氢氧储罐中共收集到67.2L气体(标准状况),则该段时间内水电解系统中转移电子的物质的量是________mol。
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO + O2,同时生成的CO可用作燃料。已知该反应的阳极反应是:
4OH--4e-=O2↑+2H2O,则阴极反应是__________________。
(18分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v (N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L 的醋酸与b mol
的醋酸与b mol L
L Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题: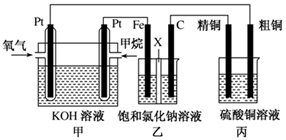
(1)甲烷燃料电池负极反应式是 ;
(2)石墨(C)极的电极反应式为 ;
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成 的气体体积为________L ,丙装置中阴极析出铜的质量为________g ;
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。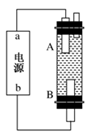
若用于制漂白液,a为电池的________极,电解质溶液最好用________;若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用________作电极。
尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂—过氧化尿素[CO(NH2)2·H2O2],其合成工艺流程如下:
请回答下列问题:
(1)操作I、II的名称分别是______、_______。CO(NH2)2·H2O2分子中尿素和过氧化氢之间以________结合,其结合力较弱,具有尿素和过氧化氢双重性质。
(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3KJ/mol、285.8kJ/mol
②
写出CH4与水蒸气作用生产CO2和H2的热化学方程式:_______________。
(3)合成过氧化氢尿素加入的稳定剂可以是水杨酸、酒石酸等。酒石酸分子式为C4H6O6,其核磁共振氢谱只有3种锋,只含羧基和羟基两种官能团,则酒石酸的结构简式为_____。
(4)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMO4溶液与尿素不反应).
①完成并配平方程式: MnO4-+
MnO4-+  H2O2+
H2O2+  _________=Mn2++
_________=Mn2++ O2↑+
O2↑+ ___;
___;
②计算出产品中H2O2的质量分数为_______。
(5)电解尿素的废水既可以处理废水,又可制得纯氢,电解原理如图所示。电解池中隔膜仅阻止气体通过,B两极均为惰性电极。B极连接电源的____极(填
“正”或“负”),阳极电极反应方程为_____________。
复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2。
(1)H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置。
若利用甲实验,可通过观察________现象,从而定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________;若利用乙实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
(2)在含有表面活性剂的酸性水溶液中,以碳为电极,通直流电进行电解可制取氢气和过氧化氢,过氧化氢在 (填“阴极”、“阳极”)产生。
以H2O2和硼氢化合物NaBH4(B的化合价为+3价)作原料的燃料电池,可用作通信卫星电源。其工作原理如图所示,写出a极上的电极反应式: ,正极材料采用MnO2,MnO2除了作电极材料之外还可能具有的作用为 
(3)锗(Ge)与碳是同主族元素,最新研究表明有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应,但在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其化学方程式为 。
(1)25℃时,0.1 mol·L-1的HA溶液中c(H+)/c(OH-)=1010。请回答下列问题:
①HA是________(填“强电解质”或“弱电解质”);
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是________(填字母)。
A.c(H+)/c(HA) B.c(HA)/(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
③若M溶液是由上述HA溶液V1 mL与pH = 12的NaOH溶液V2 mL混合充分反应而得,则下列说法中正确的是
A.若溶液M呈中性,则溶液M中c(H+) + c(OH-) = 2.0×10-7 mol·L-1
B.若V1 =V2 ,则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2
(2)若已知在25℃,AgCl的Ksp = 1.8×10-10,现将足量AgCl分别放入:①100 mL 蒸馏水中;②100 mL 0.2mol·L-1 AgNO3溶液中;③100 mL 0.1mol·L-1 AlCl3溶液中;④100 mL 0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是 (用序号连接)
(3)若1mol SO2(g)氧化为1mol SO3(g)的ΔH =-99kJ·mol-1,单质硫的燃烧热为296kJ·mol-1,则由S(s)生成3 mol SO3(g)的ΔH =
(4)对于2NO2(g) N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
①.A、C两点的反应速率:A>C
②.A、C两点气体的颜色:A深、C浅
③.B、C两点的气体的平均分子质量:B<C
④.由状态B到状态A,可以用加热方法
(5)下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图:
请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.2 mol电子通过时,阴极增重____g。
固体A可用于工业上生产硫酸,各物质间转化如下图。其中C为红棕色粉
末,D为能使品红溶液褪色的无色气体。
请回答:
(1)F的电子式为_________。
(2)若测得生成C和D的质量比为5:8,则A的化学式为______________。
(3)将D通入H溶液中发生反应的离子方程式为_____________。
(4)物质的量浓度均为0.lmol/L的G和H的混合溶液中,离子浓度由大到小的顺序
为____________。
(5)有人用电解某饱和溶液的方法同时制备G的浓溶液和浓氢氧化钠溶液,如图所
示。则:
①a端为电源的_________(填“正极”或“负极”)。
②N口收集的物质为__________(填化学式,下同。);
Q口收集的为_________浓溶液。
③某物质的饱和溶液最好选用___________(填试剂名称)。
④阳极的电极反应式为____________。
(6)检验H中金属阳离子的方法___________。