(共11分) 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
(1)电源A 极的名称是___________
(2)乙装置中电解反应的总化学方程式是________________
(3)如果收集甲、乙装置中C、D、E、F产生的物质的物质的量之比是________
(4)欲用丙装置给铜镀银,G应该是_____(填名称),电镀液的主要成分是______(填化学式)
(5)装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带_________电荷。
(6)从Cu2+、Na+、SO42-、Cl-四种离子中恰当地组成电解质,按下列要求进行电解,
写出所有符合要求的物质化学式。
①、以石墨为电极进行电解,使电解质质量减少,水质量不变,采用的电解质是________
②、以石墨为电极进行电解,使电解质质量不变,水质量减少,采用的电解质是________
③、以碳棒为阳极,铁棒为阴极进行电解,使电解质和水的质量都减少,采用的电解质是___
(16分)某研究小组拟用粗食盐(含Ca2+、Mg2+、SO 等)、粗硅(含C及不与Cl2反应的固体杂质)制取纯硅,设计如下的工艺流程:
等)、粗硅(含C及不与Cl2反应的固体杂质)制取纯硅,设计如下的工艺流程:
试回答下列问题:
(1)工业上一般是利用过量焦炭在高温下还原石英砂来制取粗硅,写出该过程的化学方程式:_______________________________________________________________________。
(2)精制粗盐水所需试剂为①BaC12;②Na2CO3;③HC1;④NaOH,其滴加的先后顺序是下列的________(填下列各项的序号)。
a.①②④③ b.④②①③ c.④①③② d.②④①③
已知, ,假设该粗盐水中
,假设该粗盐水中 的浓度均为0.01 mol·L-1,若向1 L该粗盐水中逐渐滴入一定量Na2CO3溶液,首先出现的沉淀是__________。
的浓度均为0.01 mol·L-1,若向1 L该粗盐水中逐渐滴入一定量Na2CO3溶液,首先出现的沉淀是__________。
(3)已知SiCl4的沸点是57.6℃,CC14的沸点是76.8℃。在反应器I中得到的SiCl4粗品中含有CCl4,从中得到纯净SiCl4可采用的方法是下列各项中的________(填序号)。
a.蒸馏 b.干馏 c.分液 d.过滤
反应器Ⅱ中发生反应的化学方程式为__________________________________________。
(4)下图是用离子交换膜法电解饱和食盐水的示意图,电解槽中阴极产生的气体是_____。产品A的化学式为____________。
若采用无膜电解槽电解饱和食盐水可制取次氯酸钠,试写出该反应的化学方程式__ ___。
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
(1)电源A 极的名称是___________
(2)甲装置中电解反应的总化学方程式是____________________________
(3)如果收集乙装置中产生的气体,两种气体的体积比是__________。
(4)欲用丙装置给铜镀银,G应该是___(填“铜”或“银”),电镀液的主要成分是 (填化学式)。
(5)装置丁中的现象是
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 |
⑵在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为:________________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:__________________________________________。
兴趣小组通过实验探究溶解铜的方法和本质。
(1)在热水浴中进行3个实验,部分实验报告如下表所示
| 序号 |
实验操作 |
实验现象 |
| Ⅰ |
稀硫酸中加入铜片 |
无明显变化 |
| Ⅱ |
硝酸钠溶液中加入铜片 |
无明显变化 |
| Ⅲ |
稀硫酸中加入硝酸钠溶液 |
无明显变化 |
| 再加入铜片 |
有无色气泡;溶液变蓝 |
①实验Ⅰ、Ⅱ的目的是__________________。
②实验Ⅲ中反应的本质是(用离子方程式表示)____________________。
(2)利用电化学原理实现铜溶于稀硫酸并生成氢气。
①Cu作________极。②总反应的离子方程式是____________。
Ⅰ、某化学研究性学习小组为探究元素性质的变化规律,设计了如下实验:
(1)甲同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其设计的依据是 ;但该装置存在缺陷,请指出 。
(2)乙同学设计了如图2装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。乙同学可能观察到的现象A. ;B. ;C. 。从环保角度考虑,该装置有明显不足,请指出提出改进建议 。
Ⅱ、另一化学研究性学习小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。
步骤一:电解精制:
电解时,粗铜应与电源的 极相连。阴极上的电极反应式为 。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式:
。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的信息:
| 序号 |
反应 |
平衡常数 |
| 1 |
   |
 1 1 |
| 2 |
   |
 1 1 |
请根据以上信息简要解释溶解阳极泥能够溶于王水的原因
。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程。
则 滤液中
滤液中 的浓度为
的浓度为  ,
, 的浓度为
的浓度为  。
。
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)电解饱和食盐水的化学方程式为 。
(2)常温下,某化学兴趣小组在实验室中,用石墨电极以右图装置进行电解某浓度氯化钠溶液的实验,电解一段时间后,收集到标准状况下氢气2. 24 L。(设电解前后溶液的体积均为1 L,不考虑水的蒸发或气体的溶解)(已知:lg5==0.70)
24 L。(设电解前后溶液的体积均为1 L,不考虑水的蒸发或气体的溶解)(已知:lg5==0.70)
①理论上,电解后溶液的pH= 。
②若实际测得反应后溶液的pH=13.00,则造成这种误差的原因可能是氯气和氢氧化钠溶液反应,写出该反应的离子方程式 。
(14分)二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。
(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为_________________________________________________。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是______________________________________。
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备的ClO2更适合用于 饮用水的消毒,其主要原因是___________________________________。
(3)电解法是目前研究最为热门的生产ClO2的方法之一。下图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。
①电源负极为_______极(填A或B):
②写出阴极室发生反应依次为:________________________、____________________________;
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2﹣歧化反应。若两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),此时阳极室与阴极室c(H+)之差为______________。
请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积,并检验氯气。
(1)A极发生的电极反应式是______ _______
_______  ______,
______,
B极发生的电极反应式是_______________________。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:
A接______、 _____接______ ;B接_____ 、 _____接______ 。
(3)证明产物中有Cl2的实验现象是______ 。
(4)已知电解后测得产生的H2的体积为44.8 mL(已经折算成标准状况),电解后溶液的体积为50 mL,此时溶液中NaOH的物质的量浓度为:_____ ___。
重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂。工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7)。制备装置如下图所示(阳离子交换膜只允许阳离子透过):
制备原理:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)通电后阳极室产生的现象为 ,其电极反应式是 。
(2)该制备过程总反应的离子方程式可表示为4CrO42-+4H2O="2" Cr2O72- + 4OH- +2H2↑+O2↑,若实验开始时在右室中加入38.8g K2CrO4,t分钟后测得右室中K与Cr的物质的量之比为3:2,则溶液中K2CrO4和K2Cr2O7的物质的量之比为 ;此时电路中转移电子的物质的量为 。
某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题: 
(1)电源A 极的名称是__________(正极或负极)。
(2)甲装置中的C极的电极反应式______________________________。
(3)欲用丙装置给铜镀银,G应该是______(填“铜”或“银”),电镀液的主要成分是__________(填化学式)。
(4)装置丁中的现象是__________________________。
请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积,并检验氯气(氯气有毒,可以用NaOH溶液吸收,氯气可以和碘化钾反应生成碘单质)。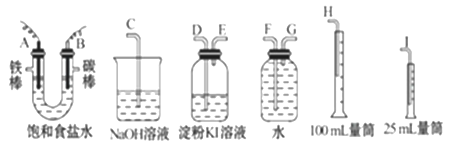
(1)A极发生的电极反应式是___________________,
B极发生的电极反应式是_______________________。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:A接______、 ______接______ ; B接______ 、 ______接______ 。
(3)证明产物中有Cl2的实验现象是_________。
(4)已知电解后测得产生的H2的体积为44.8 mL(已经折算成标准状况),电解后溶液的体积为50 mL,此时溶液中NaOH的物质的量浓度为________。
工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3做冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下图所示:
(已知:NaCl熔点为801℃;AlCl3在181℃升华)
(1)向滤液中通入过量CO2所发生反应的离子方程式为 。
(2)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为 。
(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有______。固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________。
(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为_____________。
(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是_____________。
给你提供纯锌、纯铜片和500mL0.2mol·L-1的H2SO4溶液、导线、1000mL量筒。试用下图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。
(1)如图所示,装置气密性良好,且1000mL量筒中已充满了水,则开始实验时,首先要______。
(2)a电极的反应式为_______。
b电极的反应式为_________。
(3)如果将a、b两电极的电极材料对调,U形管中将出现的现象是_________________