请从下图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。
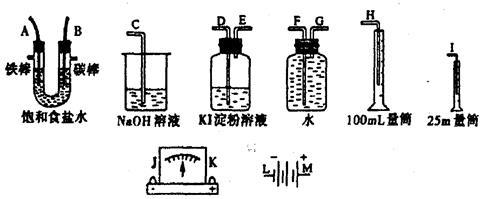
(1)电源、电流表,与A、B两极的正确连接顺序为L→J→K→( )→( )→M。
(2)B极发生的电极反应式是 。简述检验该电极产物的方法和现象 。
(3)设计上述气体实验装置时,各接口的正确连接依序为:检验氯气的氧化性时B接D 、E接C。测定产生的氢气的体积时A接_________、_________接__________。
(4)若电解饱和食盐水50mL,通电为t min时,测得产生的H2体积为 5.6mL(标况),则此时溶液的pH为 。(忽略溶液体积的变化)
.(16分)某课外活动小组同学用下图装置进行实验,试回答下列问题。
(1)若开始时开关K与a连接,则B极的电极反应式为 。
(2)若开始时开关K与b连接,则B极的电极反应式为 ,总反应的离子方程式为 ,有关该实验的下列说法正确的是(填序号) 。
①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,设想用下图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从 出口 (填写“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是海水综合利用的一个方面。
请回答下列问题:
1、①步主要反应的的离子方程式: 。
溴的用途有很多,写出其中的一种 。
2、分离出氢氧化镁的操作称为 ,第③步需要加入 ,写出该物质在水中的电离方程式: 。
3、将粗食盐中含有的Mg2+、Ca2+和SO42—等杂质除去,加入的试剂有(按加入顺序填入) 。
4、④产物氢气在 极生成,若电解食盐水时消耗NaCl的质量为234g,则在理论上最多可得氯气的体积为___ _升(标准状况)。
氯碱工业中电解饱和食盐水的原理示意图如下图所示:
(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 ;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)]。
精致流程如下(淡盐水和溶液A来自电解池):
①盐泥a除泥沙外,还含有的物质是 。
②过程Ⅰ中将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
④经过程Ⅲ处理,要求盐水中c 中剩余Na2SO3的含量小于5mg /L,若盐水b中NaClO的含量是7.45 mg /L ,则处理10m3盐水b ,至多添加10% Na2SO3溶液 kg(溶液体积变化忽略不计)。
如图所示,以石墨为电极电解A的水溶液,并做下面一系列实验。试根据实验现象完成下列问题(电解质A的水溶液焰色反应呈紫色)。
(1)A的化学式为 ,E的名称为 。
(2)I和F反应的离子方程式是 。
(3)若将电解装置中的阳极换成铁棒,则在U型管底部可观察到的现象是
,阳极的电极反应式为 ,阴极的电极反应式为 ,电解的化学方程式为 。
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如下图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答: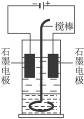
(1)阳极上的电极反应式为___________________________________。
(2)阴极上的电极反应式为___________________________________。
(3)原上层液体是___________________________________________。
(4)原下层液体是___________________________________________。
(5)搅拌后两层液体颜色发生变化的原因是________________________________________。
(6)要检验上层液体中含有的金属离子,其方法是___________________________________,现象是________________________________________。
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如图418。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答: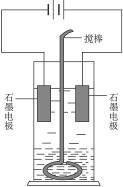
图4-18
(1)阳极上的电极反应式为_______________________。
(2)阴极上的电极反应式为_______________________。
(3)原上层液体是______________________。
(4)原下层液体是______________________。
(5)搅拌后两层液体颜色发生变化的原因是_______________________。
(6)要检验上层液体中含有的金属离子,其方法是_______________,现象是_______________。
已知在pH为4—5的环境中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生欲用电解纯净CuSO4溶液的方法,并根据电极上析出铜的质量以及电极上产生气体的体积来测定铜的相对原子质量。其实验流程如下: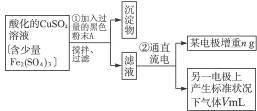

图4-16
试回答下列问题:
(1)步骤①所加入的A的化学式为________________,加入A的作用是___________________,
(2)步骤②中所用部分仪器如图4-16所示,则A应接直流电源的__________极。
(3)电解开始后一段时间,在U形管内可观察到的现象是____________,其电解总反应的离子方程式为________________________。
(4)下列实验操作属必要的是__________(填字母,下同),属不必要的是________________。
| A.称量电解前电极的质量 |
| B.电解后电极在烘干、称量前,必须用蒸馏水冲洗 |
| C.刮下电解后电极上的铜,并清洗、称量 |
| D.电极在烘干称量的操作必须按烘干→称量→再烘干→再称量进行两次 |
E.在有空气存在的情况下,电极烘干必须采用低温烘干法
(5)铜的相对原子质量为______________________。