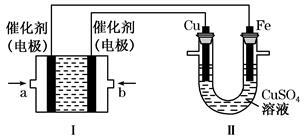
某学生欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量。其实验过程如图所示:

(1)步骤①所加的A的化学式为 ;已知:常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则加入A调pH范围是_____ ___ (已知lg2=0.3)
(2)步骤②中所用的部分仪器如右图:则A应接在直流电源的 极(填“正”或“负” )。

(3)石墨电极上的电极反应式 。
(4)下列实验操作中必要的是(填字母) 。
| A.称量电解前电极的质量 |
| B.电解后,电极在烘干称重前,必须用蒸馏水冲洗 |
| C.刮下电解后电极上析出的铜,并清洗、称重 |
| D.电极在烘干称重的操作中必须按“烘干→称重→再烘干→再称重”进行 |
E.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为 (用带有n、V的计算式表示)。
(6)若②用甲醇—O2—熔融碳酸盐电池提供电能,写出该电池负极的电极反应式
硼酸(H3BO3)与铝酸(H3AlO3)结构相似,可写成B(OH)3。
(1)已知H3BO3的电离常数为5.8×10﹣10,H2CO3的电离常数为Ka1=4.4×10﹣7、Ka2=4.7×10﹣11。向盛有饱和硼酸溶液的试管中,滴加0.1mol/L Na2CO3溶液, (填“能”或“不能”)观察到气泡逸出。
(2)已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH﹣=B(OH)4﹣,写出硼酸的电离方程式 ,它是 元酸。(填“一”或“二”或“三”)
(3)硼酸和甲醇在浓硫酸存在下生成B(OCH3)3,B(OCH3)3可与NaH反应制得易溶于水的强还原剂硼氢化钠(NaBH4)。①NaBH4中氢元素的化合价为 ,写出生成NaBH4的化学方程式 。
②写出生成B(OCH3)3的化学方程式 。
③用NaBH4和过氧化氢可以设计成一种新型碱性电池。该电池放电时,每摩尔NaBH4释放8mole﹣。写出这种电池放电反应的离子方程式 。
(4)H3BO3可以通过电解的方法制备。工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。

①写出阳极的电极反应式 。
②分析产品室可得到H3BO3的原因 。
(5)过硼酸钠晶体(NaBO3·4H2O)是一种优良的漂白剂,在70℃以上加热会逐步失去结晶水。 实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T2℃时所得晶体的化学式为 。

(1)已知:① 2H2(g)+O2(g)=2H2O(l) △H1=" -a" kJ•mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 =" -b" kJ•mol-1
③ CO(g)+2H2(g) CH3OH(g) △H3 =" -c" kJ•mol-1
CH3OH(g) △H3 =" -c" kJ•mol-1
计算甲醇蒸气的标准燃烧热H=
(2)①As2S3和HNO3反应如下:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,将该反应设计成原电池,则NO2应该在 (填“正极”或“负极”)附近逸出,该极的电极反应式为 。
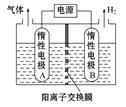
②利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为 溶液(填化学式),阳极电极反应式为 ,电解过程中Li+向 电极迁移(填“A”或“B”)。
③利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
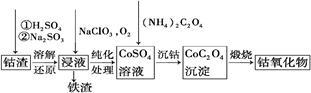
Co(OH)3溶解还原反应的离子方程式为 。
某硫酸厂用以下几种方法处理SO2尾气。

(1)活性炭还原法
反应原理:恒温恒容2C (s)+2SO2(g) S2(g)+2CO2(g) 。
S2(g)+2CO2(g) 。
反应进行到不同时间测得各物质的浓度如图:
①第一次出现平衡的时间是第 min;
②0~20min反应速率表示为V(SO2)= ;
③30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是 ;40min时,平衡常数值为__________。
(2)亚硫酸钠吸牧法
①Na2SO3溶液吸收SO2的离子方程式为 ;
②常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是____(填序号)
a.c(Na+)+c(H+) >c(SO32-)+c(HSO3-)+ c(OH-)
b.c(Na+) = c(SO32-) + c(HSO3-)+ C(H2SO3)
c.c(Na+)> c(SO32-)> c(OH-)>c(H+)
d.水电离出c(OH一)=l×l0-8 mol/L,
(3)电化学处理法
如图所示,Pt(1)电极的反应式为 ;碱性条件下,用Pt(2)电极排出的S2O42-溶液吸收NO2,使其转化为N2,同时有SO32-生成。若阳极转移电子6mol,则理论上处理NO2气体 mol。

铜、铁及其化合物在工业、农业、科技和日常生活中有广泛应用。
(1)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜。为了测定辉铜矿样品的纯度,用酸性高锰酸钾溶液反应(已知1 molCu2S失去10mol的电子),写出该反应的离子方程式 。
(2)工业上利用废铜屑、废酸(含硝酸、硫酸)为主要原料制备硫酸铜晶体。某含有c(HNO3)="2" mol·L—1,c(H2SO4)="4" mol·L—1的废酸混合液100 mL(不含其它酸或氧化剂),最多能制备硫酸铜晶体(CuSO4·5H2O)的质量为 。
(3)现有一块含有铜绿的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同。(已知:金属生锈率= )
)
①上述铜片中铜的生锈率为 (结果保留2位有效数字)
②固态铜与适量氧气反应,能量变化如下图所示,写出固态铜与氧气反应生成1 mol固态氧化亚铜的热化学方程式 。

(4)高铁酸盐在能源环保等领域有广泛用途,如高铁酸钾(K2FeO4) 因有强氧化性,能杀菌消毒,产生Fe(OH)3有吸附性,是一种新型净水剂,用如下图所示的装置可以制取少量的高铁酸钾。
(已知爱迪生蓄电池的反应式为: )
)

①爱迪生蓄电池的负极材料是
②写出制取高铁酸钾阳极的电极反应式
③当生成19.8g的K2FeO4时,隔膜两侧电解液的质量变化差(△m右一△m左)为_ g。
甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的两个反应:
反应I: CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 (填“I”或“II”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断反应I为______热反应(填“吸”或“放”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从表中选择)。
(2) 已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 kJ/mol
② 2CO(g)+ O2(g)= 2CO2(g) ΔH2 kJ/mol
③ H2O(g)= H2O(l) ΔH3 kJ/mol
则反应CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ΔH= kJ/mol
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O2‾7)时,实验室利用下图装置模拟该法:

① N电极的电极反应式为 。
② 请完成电解池中Cr2O2‾7转化为Cr3+的离子反应方程式:
Cr2O7 2‾+ Fe2+ + [ ] ═= Cr3++ Fe3++ H2O
(4) 处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10‾5 mol•L﹣1时,Cr3+沉淀完全,此时溶液的pH= 。(已知, Ksp[Cr(OH)3]=6.4×10‾31,lg2=0.3)
下图是一个化学过程的示意图。

(1)图中甲池中OH-移向 极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为 极(填“A”或"B”),并写出此电极的反应式:____ 。
(4)乙池中总反应的离子方程式:____ 。
(5)当乙池中B(Ag)极的质量增加5.4g时,乙池的pH是 (若此时乙池中溶液的体积为500mlL);此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是 (填序号)。
| A.MgSO4 | B.CuSO4 | C.AgNO3 | D.AlCl3 |
氨气在生产、生活和科研中应用十分广泛
(1)传统工业上利用氨气合成尿素
①以CO2与NH3为原料合成尿素的主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+ 72.49 kJ·mol-1
反应2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH= kJ·mol-1。
②液氨可以发生电离:2NH3(l) NH2- + NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式 。
NH2- + NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式 。
(2)氨气易液化,便于储运,可利用NH3作储氢材料
已知:2NH3(g) N2(g) + 3H2(g) ΔH=+92.4 kJ·mol-1
N2(g) + 3H2(g) ΔH=+92.4 kJ·mol-1
① 氨气自发分解的反应条件是 (填“低温” 或 “高温”)。
②其他条件相同,该反应在不同催化剂作用下反应,相同时间后,氨气的转化率随反应温度的变化如右图所示。
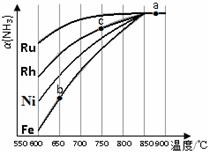
在600℃时催化效果最好的是 (填催化剂的化学式)。c点氨气的转化率高于b点,原因是 。
(3)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,把垃圾渗滤液加入到如图所示的电解池(电极为惰性材料)进行电解除去NH3,净化污水。该净化过程分两步:第一步电解产生氧化剂,第二步氧化剂氧化氨氮物质生成N2。
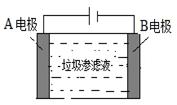
①写出电解时A极的电极反应式: 。
②写出第二步反应的化学方程式: 。
以氨气代替氢气研发氨燃料电池是当前科研的一个热点.
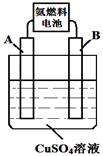
(1)氨燃料电池使用的电解质溶液是2 mol·L-1的KOH溶液,电池反应为:4NH3+3O2 =2N2+6H2O。该反应每消耗1.7g NH3转移的电子数目为 ;
(2)用氨燃料电池电解CuSO4溶液,如右图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,则B电极上发生的电极反应式为 ;此时向所得溶液中加入8gCuO固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为 L.
(3)纳米级氧化亚铜(Cu2O)是一种重要光电材料。现用铜棒和石墨做电极,饱和食盐水做电解质制备纳米级氧化亚铜(Cu2O),电解反应为 。铜棒上发生的电极反应式为
。铜棒上发生的电极反应式为
甲烷作为一种新能源在化工领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ;ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g) ;ΔH=﹣566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为: _____________________.
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①a处应通入_____(填“CH4”或“O2”),b处电极上发生的电极反应式是:
②电镀结束后,装置Ⅰ中溶液的pH值_____(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度 .
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH―以外还含有_____(忽略水解).
④在此过程中若完全反应,装置Ⅱ中阴极质量变化为12.8 g,则装置Ⅰ中理论上消耗甲烷_______L(标准状况下).
(1)某课外兴趣小组用下图装置进行实验,试回答:

①若开始时开关K与a连接,则A的电极反应式为_________。
②若开始时开关K与b连接,这种方法经常用于金属的防护,这种防护措施叫做_______。
③开关K与b连接,铁和石墨棒互换位置即可制得白色的较纯净Fe(OH)2沉淀,则铁电极反应式为_______。
(2)如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答以下问题:

①电极A的名称是_______。
②甲装置中D电极的电极反应式:_______。
③在25℃时若用惰性电极电解饱和 NaCl溶液一段时间,当阳极产生5.6L(标准状况下)一种气体,电解后溶液体积为50L时,求所得溶液在25℃时的氢氧化钠物质的量浓度=_______。
④欲用丙装置给铜镀银,G应该是________(填“银”或“铜”),电镀液的主要成分是(填化学式)_______。
(1)在25℃、101 kPa下,1 g甲烷完全燃烧后,恢复到原状态放热Q kJ,则表示甲烷燃烧热的热化学方程式为_________________ 。
(2)肼(N2H4)一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为 。
(3)如图装置中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为 (选填“变大”、“变小”、“不变”)。通电一段时间后(溶液中还有CuSO4),若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入 (填序号).
| A.CuO | B.Cu(OH)2 | C.CuCO3 | D.Cu2(OH)2CO3 |

(4)下图是用于笔记本电脑的甲醇(CH3OH)燃料电池结构示意图,质子交换膜左右两侧的溶液均为500mL 2 mol/LH2SO4 溶液,当电池中有1mol e-发生转移时,左右两侧溶液的质量之差为 (忽略气体的溶解,假设反应物完全耗尽)。

Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用。
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H= kJ·mol-1。
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g) 设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有:

①燃料电池即电源的N极的电极反应式为 _______________________;
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 。
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g)  N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(N0)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:

①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____(保留小数点后三位)。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 。(填序号)。
A.增加CO的量 B.加入催化剂 C.减小容器体积 D.扩大容器体积
用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,测得溶液pH变化如右图所示。
(1)在0→t1时间内,阳极上的电极反应式为:___________________________;
(2)用离子方程式表示:a点 pH﹥7原因:__________________________;0→t1时间内,溶液pH升高比较缓慢的原因:_______________________
(3)从原溶液中溶质变化角度看,t1时刻的意义是________________________
(4)有人利用电解原理开发出了一种家用“84”消毒液(有效成分为NaClO)发生器(构造如图),在制备该消毒液时,a电极应该连接在电源的________________极上,若两个电极一种是铁、一种是石墨,则b极材料是________________。
世界能源消费的90%以上依靠化学技术。
(1)工业制氢的一个重要反应是利用CO还原H2O(g)。已知:
C(石墨,s)+O2(g)═CO2(g)△H="-394k" J/mol
2C(石墨,s)+O2(g)═CO(g)△H="-222k" J/mol
H2(g)+ 1/2O2(g)═H2O(g)△H="-242k" J/mol
则CO还原H2O(g)的热化学方程式为_________________。
(2)氢能被视为最具发展潜力的绿色能源,写出碱式氢氧燃料电池的工作时的负极电极反应:_______。
(3)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如下图,写出该电池充电时的阳极电极反应__________。


(4)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备装置如上图。气体a通入淀粉KI溶液中,发现溶液变蓝,持续一段时间后,蓝色逐渐褪去。则M极为电源的________(填“正”或“负”)极,B极区电解液为_______溶液(填化学式),该离子交换膜是________(填“阳”或“阴”)离子交换膜,解释蓝色褪去的原因______________________。