右图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH=2K2CO3+6H2O

(1)请回答图中甲、乙两池的名称。甲电池是 装置,乙池是 装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是 ,B(石墨)电极的名称是 。
(3)写出电极反应式:
通入O2的电极的电极反应式是 。
A(Fe)电极的电极反应式为 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
研究发现,含pm2.5的雾霾主要成分有SO2、NOx、CxHy及可吸入颗粒等。
(1)雾霾中能形成酸雨的物质是_____________。
(2)为消除NOx对环境的污染,可利用NH3在一定条件下与NO反应生成无污染的气体。
已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =" -905.48" kJ·mol-1
4NO(g)+6H2O(g) △H =" -905.48" kJ·mol-1
N2(g)+O2(g) 2NO(g) △H =" +180.50" kJ·mol-1
2NO(g) △H =" +180.50" kJ·mol-1
①下列表示NH3(g)与NO(g)在一定条件下反应,生成无污染气体的能量转化关系示意图正确的是:___________(填字母)

② 右图是反应4NH3(g)+6NO(g) 5N2(g)+6H2O(g)过程中NH3的体积分数随X变化的示意图,X代表的物理量可能是_________,原因是_________。
5N2(g)+6H2O(g)过程中NH3的体积分数随X变化的示意图,X代表的物理量可能是_________,原因是_________。

(3)右图电解装置可将雾霾中的SO2、NO转化为(NH4)2SO4,

① 阴极的电极反应式是 。
② 物质A是_____________(填化学式),理由是_________________________。
(4)为减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示,请解释:

① 随空/燃比增大,CO和CxHy的含量减少的原因是 。
② 当空/燃比达到15后,NOx减少的原因可能是_____________。
ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂,制备ClO2的新工艺是电解法。
(1)如图表示用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,写出阳极产生ClO2的电极方程式:__________________________________;图中b电极为_____________(填“阳极”或“阴极”)。
(2)电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为________mol,阴极区pH________(填“变大”“变小”或“不变”)。
(3)ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂中污水含CN-(a mol·L-1),现将ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:_____________________。
工业上制取氢气除电解水外还有多种方法.
(1)工业上可用组成为K2O•M2O3•2RO2•nH2O的无机材料纯化制取氢气.
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R在周期表的位置为 .
②常温下,不能与M单质发生反应的是 (填序号).
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)工业上也可利用化石燃料开采、加工过程中产生的H2S废气制取氢气.
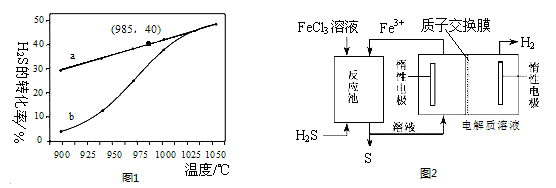
①高温热分解法 已知:H2S(g)⇌H2(g)+S(g)
在恒温密闭容器中,控制不同温度进行H2S分解实验.以H2S起始浓度均为c mol•L﹣1测定H2S的转化率,结果见图1.图中a为H2S的平衡转化率与温度关系曲线,b为表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率的变化曲线.据图计算985℃时H2S按上述反应分解的平衡常数K= ;随着温度的升高,曲线b向曲线a逼近的原因是
②电化学法:该法制取氢气的过程如图2所示.反应池中反应物的流向采用气、液逆流方式,其目的是 ;反应池中发生反应的化学方程式为 .
反应后的溶液进入电解池,电解总反应的离子方程为 .
(3)H2S在足量氧气中燃烧可以得SO2,若在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含SO3 0.18mol.若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,SO3的物质的量的取值范围为 mol.
富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可制备新型净水剂液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。研究发现,当a=b时净水效果最好。工艺流程如下(部分操作和产物略):
(1)A12O3与H2SO4发生反应的离子方程式是____________。
(2)测得滤液中 。加入FeSO4·7H2O和H2O2的作用是(结合化学用语说明)____________。
。加入FeSO4·7H2O和H2O2的作用是(结合化学用语说明)____________。
(3)将溶液A电解得到液体聚合硫酸铝铁。装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极)
① 阴极室的电极反应式是__________。
② 电解过程阳极室溶液pH的变化是____________(填“增大”、“减小”或“不变”)。
③ 简述在反应室中生成液体聚合硫酸铝铁的原理____________。
A、B、C、D是四种短周期元素,它们的原子序数依次增大。其中A、D元素同主族,B、
C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示:
| 化合物 |
甲 |
乙 |
丙 |
丁 |
| 组成元素 |
B、C |
A、C |
A、D |
C、D |
常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物。请填写下列空白:
(1)丙物质的化学式为 ,丁物质中阴离子与阳离子的个数之比为 。
(2)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为 。
(3)某同学设计了一个以结构简式为 BA3-CA的物质为燃料的电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如下图:

①写出ⅰ中通入该物质这一极的电极反应式 。

②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ;原混合液中CuSO4溶液物质的量浓度为 mol/L。
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3  H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式____________________________。
②某温度下,0.1000 mol·L-1的H3PO3溶液pH的读数为1.6,即此时溶液中
c (H+) = 2.5×10-2 mol·L-1,除OH-之外其他离子的浓度由小到大的顺序是 ,该温度下H3PO3电离平衡的平衡常数K= 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
③向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中
c(Na+)_______ c(H2PO3-)+ 2c(HPO32-)(填“>”、 “<” 或“=”)。
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式_______________________。
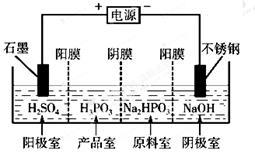
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为________________________。
②产品室中反应的离子方程式为________________。
甲醇又称“木醇”,是无色有酒精气味易挥发的有毒液体。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g) CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g) △H=Q2kJ·mol-1
CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H=Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为 。
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为___________________________________。
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为1×10-3mol,则理论上生成的SO42-为________mol。
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
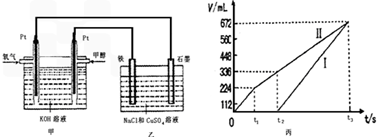
(4)写出甲中通入甲醇这一极的电极反应式________________________________。
(5)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式____________,原混合溶液中 NaCl的物质的量浓度为________mol/L。(设溶液体积不变)
(6)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为_______g。
(7)若使上述电解装置的电流强度达到5.0A,理论上每分钟应向负极通入气体的质量为_____克。(已知1个电子所带电量为1.6×10-19C,计算结果保留两位有效数字)
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
① 已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1= +489.0 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ/mol
则CO还原Fe2O3的热化学方程式为 ;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO,PdCl2被还原成单质,反应的化学方程式为 ;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池。
① 负极电极反应式是: ;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)

A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| H2O |
CO |
CO2 |
|||
| 1 |
650 |
2 |
4 |
1.6 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
3 |
| 3 |
900 |
1 |
2 |
0.4 |
1 |
①该反应的正反应为 (填“吸”或“放”)热反应;
②实验2中,平衡常数K= ;
③实验3跟实验2相比,改变的条件可能是 (答一种情况即可)
知识的梳理和感悟是有效学习的方法之一。某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)。

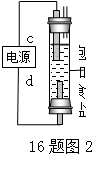
(1)图1中,电解一段时间后,气球b中的气体是___________(填化学式),U形管__________(填“左”或“右”)边的溶液变红。
(2)利用图2制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分,则c为电源的________极;该发生器中反应的总离子方程式为___________________。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质传输与转化关系如图3所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。

图3
①燃料电池B中的电极反应式分别为:负极_______________,正极______________。
②分析图3可知,氢氧化钠的质量分数a%、b%、c%由大到小的顺序为___________。
根据如图所示装置回答:

(1)当X为Pt, Y为Fe, Z为AgNO3时,阳极反应为 ,阴极反应为
(2)X为Cu,Y为Fe,Z为CuSO4时,阳极反应为 ,阴极反应为 。
(3)用铂电极电解CuSO4和KNO3的混合液500mL,经过一段时间后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为 mol/L
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1;
C(石墨)+CO2(g)==="2CO(g)" ΔH2=+172.5 kJ·mol-1。
则CO还原Fe2O3(s)的热化学方程式为________________________
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①该反应的平衡常数表达式为K=_____________。
②取一定体积的CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图Z76(a)所示,则该反应的ΔH________0(填“>”“<”或“=”)。

(a) (b)
图Z76
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间的变化关系如图(b)所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KI________KⅡ(填“>”“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为:____________
2NH3+CO2  CO(NH2)2+H2O当氨碳比
CO(NH2)2+H2O当氨碳比 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_________。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_________。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为________。
甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇CO(g)+2H2(g)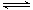 CH3OH(g) ΔH
CH3OH(g) ΔH
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250 ℃ |
300 ℃ |
350 ℃ |
| K |
3.041 |
1.000 |
0.120 |
由表中数据判断ΔH________0 (填“>”、“=”或“<”),化学平衡常数表达式K= ;
(2)300 ℃时,在体积为2.0 L的密闭容器中通入2 mol CO和4 mol H2 ,经过20 s 达到平衡状态,
①计算20 s内CO的反应速率为 ,此时容器中甲醇的体积分数为 ;
②若向上述平衡体系中同时加入1mol CO,2mol H2 和1mol CH3OH气体,平衡移动情况是__________(填“向右”、“向左”或“不移动”),原因是 ;
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH1=-1277.0 kJ/mol
②2CO(g)+O2(g) = 2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g) = H2O(l) ΔH3=-44 kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: ;
(4)甲醇,氧气可制作燃料电池,写出以氢氧化钾为电解质甲醇燃料电池负极反应式 ;如图,电解KI溶液制碘,在粗试管中加入饱和的KI溶液,然后再加入苯,插入一根石墨电极和一根铁电极,使用该燃料电池做电源,铁电极与 极(填正或负)相连接,通电一段时间后,断开电源,振荡试管,上层溶液为 色,当有1.27g 碘单质生成时,需要 g CH3OH。

S02的含量是空气质量日报中一项重要检测指标,也是最近雾霾天气肆虐我国大部分地区的主要原因之一。加大S02的处理力度,是治理环境污染的当务之急。
I.电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如右图所示(电极均为惰性材料):

(1)M极发生的电极反应式为________________。
(2)若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为 L(已知:1个e所带电量为1.6×10-19C)。
Ⅱ,溶液与电化学综合(钠碱循环法)处理SO2。
(3)钠碱循环法中,用Na2SO3溶液作为吸收液来吸收SO2,该反应的离子方程式为 。
(4)吸收液吸收SO2的过程中,pH随n(SO32-)/n(HSO3-)变化关系如右图所示:

①用图中数据和变化规律说明NaHSO3溶液呈酸性的原因 。
②n(SO32-)/n(HSO3-)=1:1时,溶液中离子浓度由大到小的顺序是 。
(5)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,其电解示意图如下:

①写出阳极发生的电极反应式 ;
②当电极上有2 mol电子转移时阴极产物的质量为 。
(1)CH3OH是一种可燃性的液体。
已知:① CH3OH (g)+H2O (l)=CO2 (g)+3H2 (g);△H= +93.0KJ·mol-1
② CH3OH (g)+1/2O2 (g)=CO2 (g)+2H2 (g);△H= -192.9KJ·mol-1
③ CH3OH (g)= CH3OH (l);△H= -38.19KJ·mol-1
则表示CH3OH的燃烧热的热化学方程式为
(2)燃料电池是符合绿色化学理念的新型发电装置,CH3OH—空气燃料电池是一种碱性(20%—30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为 。
(3)右图是一个电解过程示意图,假设使用CH3OH—空气燃料电池作为本过程中的电源,其中a为电解液,X和Y是两块电极板。
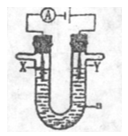
①若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,Y极板上发生的电极反应式为: 。
②若X、Y分别为石墨和铜,a为CuSO4溶液,铜片的质量变化128g,则 CH3OH一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积分数为20%)
(4)已知高锰酸钾能氧化甲醇,也能氧化草酸。查阅资料,乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸。
①请配平该反应的离子方程式:
______MnO4-+______H2C2O4+______===____Mn2++______CO2↑+______。
②某兴趣小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,形成的溶液中各离子的浓度由大到小的顺序为___________________(用离子符号表示)。